题目内容
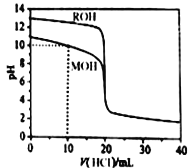
【题目】某镍冶炼车间排放的漂洗废水中含有一定浓度的Ni2+和Cl-,图甲是双膜三室电沉积法回收废水中Ni2+的示意图,图乙描述的是实验中阴极液pH与镍回收率之间的关系。下列说法不正确的是
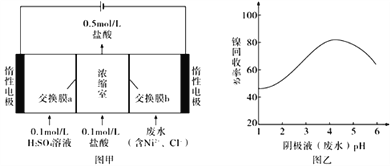
A. 交换膜b为阴离子交换膜
B. 阳极反应式为2H2O-4e-=O2↑+4H+
C. 阴极液pH= 1时,镍的回收率低主要是有较多H2生成
D. 浓缩室得到1L 0.5 mol/L盐酸时,阴极回收得到11.8 g镍
【答案】D
【解析】从电解的示意图可知,最后要得到0.5mol/L的盐酸溶液,因此阴极室内,Ni2++2e-=Ni,溶液中氯离子通过离子交换膜b进入浓缩室内,因此,交换膜b为阴离子交换膜,A正确;电解质为硫酸溶液,阳极内时氢氧根离子失电子生成氧气,极反应式为2H2O-4e-=O2↑+4H+,产生的氢离子通过阳离子交换膜进入浓缩室内,B正确;阴极液pH=1时,溶液中氢离子浓度较大,2H++2e-=H2↑,Ni2+被还原的量减少,因此镍的回收率低,C正确;根据题意可知,浓缩室得到1L 0.5 mol/L盐酸时,新生成的盐酸溶质的量为0.5-0.1=0.4 mol,即阴极有0.4 mol氯离子进入浓缩室,阴极共得电子0.4 mol,若全部为镍离子得电子,根据极反应Ni2++2e-=Ni可知,转移电子0.4 mol 生成11.8 g镍,但是溶液中还会有少量的氢离子得电子,所以生成的镍的质量少于11.8 g,D错误;正确选项D。

【题目】某课题组以硫铁矿烧渣(含 Fe2O3、 Fe3O4、 Al2O3、 CaO、 SiO2 等)为原料制取软磁用 Fe2O3(要求纯度>99.2%, CaO 含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
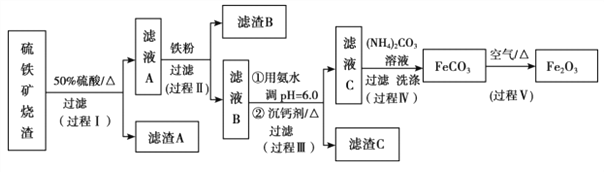
已知:生成氢氧化物的 pH 如下表所示
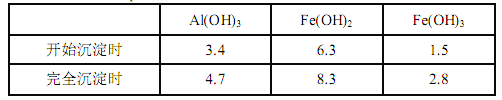
(1)滤渣 A 的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。
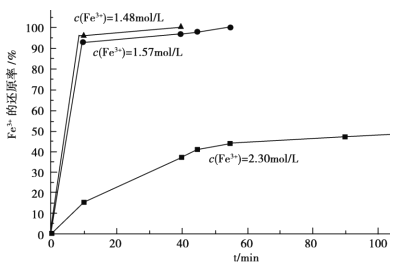
(3)在过程Ⅱ中,课题组对滤液 A 稀释不同倍数后,加入等质量的过量铁粉,得出 Fe3+浓度、还原率和反应时间的关系如图所示:结合上述实验结果说明:课题组选择稀释后c(Fe3+)为 1.60mol/L 左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:(已知:滤液 B 中钙的含量以 CaO 计为 290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果, 选择适宜的沉钙剂,得到滤渣 C 的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在 35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。