题目内容
【题目】实验室用高锰酸钾和浓盐酸制取氯气,反应方程式如下:
[___]KMnO4+[___]HCl(浓)→[___]KCl+[___]MnCl2+[___]Cl2+[___]H2O
(1)配平上述反应的化学方程式,并用单线桥标出电子转移方向和数目。__________
(2)反应中,HCl 体现的化学性质为____。
(3)若反应消耗 2molHCl,转移电子数目为_____个。
(4)将SO2气体通入KMnO4溶液中,溶液褪色,生成Mn2+.写出发生反应的离子方程式________。
【答案】2 16 2 2 5 8 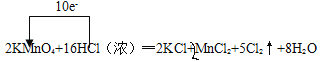 酸性和还原性 1.25NA 5SO2+2MnO4﹣+2H2O=2Mn2++5SO42﹣+4H+
酸性和还原性 1.25NA 5SO2+2MnO4﹣+2H2O=2Mn2++5SO42﹣+4H+
【解析】
(1)反应中KMnO4→MnCl2,Mn元素化合价由+7降低为+2,共降低5价,HCl(浓)→Cl2,Cl元素化合价由﹣1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,根据化合价变化标出电子转移的方向和数目;
(2)反应中盐酸中部分Cl化合价升高表现还原性,部分Cl化合价不变得到盐,表现酸性;
(3)根据化合价升降进行电子转移的计算;
(4)酸性高锰酸钾具有强氧化性,被还原为锰离子,二氧化硫可以被还原为硫酸根离子,据此书写。
(1)反应中Mn元素化合价由+7降低为+2,共降低5价,HCl(浓)→Cl2,Cl元素化合价由﹣1价升高为0价,共升高为2价,化合价升降最小公倍数为10,故KMnO4的系数为2,Cl2的系数为5,再根据原子守恒配平其它物质的系数,配平后的方程式为2KMnO4+16HCl(浓)═2KCl+2MnCl2+5Cl2↑+8H2O,电子转移情况如下: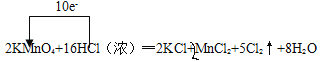 ,故答案为:2;16;2;2;5;8;
,故答案为:2;16;2;2;5;8;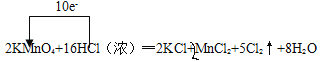 。
。
(2)反应中盐酸中部分Cl化合价升高表现还原性,部分Cl化合价不变得到盐,表现酸性;故答案为:酸性和还原性;
(3)如反应中转移了10mol电子,则消耗盐酸是16mol,若反应消耗2molHCl,转移电子数目为1.25NA,故答案为:1.25NA;
(4)酸性高锰酸钾具有强氧化性,被还原为锰离子,二氧化硫可以被氧化为硫酸根离子,反应为:5SO2+2MnO4﹣+2H2O=2Mn2++5SO42﹣+4H+,故答案为:5SO2+2MnO4﹣+2H2O=2Mn2++5SO42﹣+4H+。

 直通贵州名校周测月考直通名校系列答案
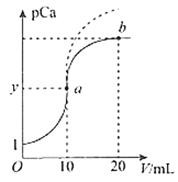
直通贵州名校周测月考直通名校系列答案【题目】25 ℃,两种酸的电离平衡常数如下表,下列叙述正确的是( )
Ka1 | Ka2 | |
H2A | 1.3×10-2 | 6.3×10-6 |
H2B | 4.2×10-7 | 5.6×10-11 |
A. H2A的电离方程式:H2A 2H++A2-
B. 常温下,在水中Na2B的水解平衡常数为:![]()
C. 相同pH的Na2A、Na2B溶液中物质的量浓度:c(Na2A)>c(Na2B)
D. 向Na2B溶液中加入少量H2A溶液,可发生反应:B2-+H2AA2-+H2B