题目内容
【题目】下表为元素周期表的一部分:
族 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
I. 请参照元素①-⑥在表中的位置,用化学用语回答下列问题:
(1)画出元素②的离子结构示意图______________。
(2
(3)元素④和⑥形成的化合物的电子式:____________________。
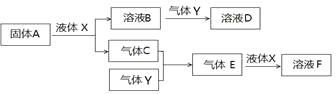
II. 由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答:
(4)写出固体A与液体X反应的离子方程式 。
(5)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,写出过量的Y与B
溶液反应的离子方程式__________________________________________________
(6)若气体C与Y在恒容绝热的条件下反应,下列哪些说法说明该反应达到平衡状态:_______
A. 温度不变
B. 2v正(C)=v逆(Y)
C.混合气体的密度不变
D.混合气体的平均相对分子质量不变
【答案】Ⅰ.(1) (1分) (2)S2->O2-> Na+(1分)
(1分) (2)S2->O2-> Na+(1分)
(3)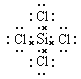 (1分)
(1分)
Ⅱ.(4)2Na2O2+2H2O=4Na++ 4OH―+ O2↑(2分)
(5)SO2 + OH-= HSO3-(2分)(6)ABD(2分)(6分)
【解析】试题分析:Ⅰ.由元素在周期表中的位置可知,①为H、②为O、③为Na、④为Si、⑤为S、⑥为Cl.
(1)元素②的离子为O2-,原子核外有10个电子,离子结构示意图为![]() ;
;
(2)电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,所以离子半径大小顺序是S2->O2->Na+;
(3)元素④与⑥形成化合物为SiCl4,属于共价化合物,硅原子和每个Cl原子之间都存在共价键,其电子式为![]() ;
;
Ⅱ.由上述部分元素组成的物质,A是一种淡黄色固体,则A为Na2O2,能与液态X反应生成气体C与B的溶液,可推知X为H2O、B为NaOH、C为O2;
(4)过氧化钠和水反应生成NaOH和氧气,离子方程式为2Na2O2+2H2O=4Na++4OH-+O2↑;
(5)气体Y是一种大气污染物,直接排放会形成酸雨,Y为SO2,过量的二氧化硫与NaOH反应生成NaHSO3,反应离子方为:SO2+OH-=HSO3-;
(6)A.绝热条件下,随反应进行温度升高,温度不变时说明到达平衡,故A正确;B.由方程式可知2v正(C)=v正(Y),而2v正(C)=v逆(Y),说明二氧化硫的生成速率与消耗速率相等,反应到达平衡,故B正确;C.混合气体总质量不变,容器容积不变,混合气体的密度始终不变,故C错误;D.混合气体总质量不变,随反应进行混合气体物质的量减小,混合气体相对分子质量增大,当混合气体的平均分子量不变,说明反应到达平衡,故D正确;故选ABD。

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案【题目】下列物质既能因发生化学反应使溴水褪色,又能使酸性KMnO4溶液褪色的是( )
①SO2 ②![]() ③
③![]()
④![]() ⑤CH
⑤CH![]() C CH3⑥CH3(CH2)4CH3
C CH3⑥CH3(CH2)4CH3
A. ①②③④ B. ③④⑤ C. ①②④⑥ D. ①②⑤
【题目】(1)用正确的序号填空: ①12C、13C、14C; ②红磷和白磷; ③H2O和D2O;④CH3CH2OH与CH3OCH3; ⑤CH4和CH3CH3;
互为同位素的是 ; 互为同素异形体的是 ;
互为同分异构体的是 ; 互为同系物的是
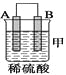
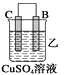
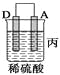
(2)由A、B、C、D四种金属按下表中装置进行实验。
装置 |
|
|
|
现象 | 金属A不 | C的质 | A上有气 |
根据实验现象回答下列问题:
①装置甲中作正极的是________ (填“A”或“B”) 。
②装置乙溶液中Cu2+向_______极移动(填“B”或“C”)。
③装置丙中金属A上电极反应属于______(填“氧化反应”或“还原反应”)。
④四种金属活动性由强到弱的顺序是_______。