��Ŀ����
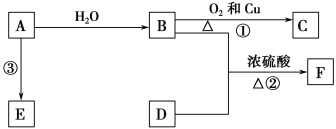
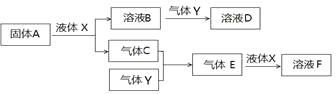
����Ŀ������ѧ����ѡ��2����ѧ�뼼�������������KMnO4����һ�ֳ�������������Ҫ���ڻ�������������ҩ��ҵ�ȡ������̿�����Ҫ�ɷ�ΪMnO2��Ϊԭ������������صĹ���·�����£�

�ش��������⣺
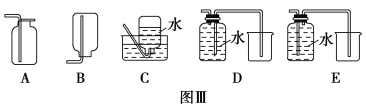
��1��ԭ�����̿����������ذ�1��1�ı��������泴�����л��䣬����ǰӦ�����̿���飬�������� ��
��2����ƽ¯���з����Ļ�ѧ����ʽΪ ��
��3����ƽ¯������Ҫ��ѹ����Ŀ���� ��
��4����K2MnO4ת��ΪKMnO4�����������ֹ��ա�
�١�![]() �绯�����Ǵ�ͳ���գ�����K2MnO4��Һ��ͨ��CO2���壬ʹ��ϵ�����Ի������ԣ�K2MnO4�����绯��Ӧ����Ӧ������K2MnO4��MnO2�� ��д��ѧʽ����
�绯�����Ǵ�ͳ���գ�����K2MnO4��Һ��ͨ��CO2���壬ʹ��ϵ�����Ի������ԣ�K2MnO4�����绯��Ӧ����Ӧ������K2MnO4��MnO2�� ��д��ѧʽ����
�ڡ���ⷨ��Ϊ�ִ����գ������K2MnO4ˮ��Һ�����������������ĵ缫��ӦΪ �������ݳ��������� ��
�ۡ���ⷨ������![]() �绯�����У�K2MnO4������������֮��Ϊ ��
�绯�����У�K2MnO4������������֮��Ϊ ��
��5��������ش��ȵIJⶨ����ȡ1.0800 g��Ʒ���ܽ������100 mL����ƿ�У�ҡ�ȡ�ȡŨ��Ϊ0.2000 mol��L1��H2C2O4����Һ20.00 mL������ϡ�����ữ����KMnO4��Һƽ�еζ����Σ�ƽ�����ĵ����Ϊ24.48 mL������Ʒ�Ĵ���Ϊ
���г�����ʽ���ɣ���֪2MnO4-+5H2C2O4+6H+=2Mn2++10CO2��+8H2O����
���𰸡���1������Ӧ��Ӵ�������ӿ췴Ӧ���ʣ����ԭ�������ʣ�
��2��2MnO2+O2+4KOH![]() 2K2MnO4+2H2O��
2K2MnO4+2H2O��
��3�����������ѹǿ���ӿ췴Ӧ���ʼӿ죬�������̿��ת���ʣ�
��4�� �� KHCO3����MnO42--e-=MnO4-��H2����3:2��
��5�� ![]() ��
��
��������
�����������1�� MnO2�ǹ������ʣ������й���μӵĻ�ѧ��Ӧ��������Ũ�Ȳ��䣬��˿�ͨ�������䷴Ӧ�Ӵ�������ķ�������߷�Ӧ���ʣ�ʹ��������̿�Ӧת��Ϊ������Ӷ������ת���ʣ����Ҫ��������ϸС�Ŀ�������2�� ��������ͼ��֪������ƽ¯����MnO2��KOH��O2�ڼ���ʱ�ᷴӦ����K2MnO4����Ϸ�Ӧǰ�����Ԫ�ص�ԭ�Ӹ�����ԭ������䣬�����������غ㶨�ɿ�֪������һ������������H2O������ԭ���غ㡢�����غ�ɵ÷����Ļ�ѧ����ʽΪ2MnO2+O2+4KOH![]() 2K2MnO4+2H2O ����3������������Ӧ��������״̬����̬������ƽ¯��������ѹǿ���Ϳ���ʹ��Ӧ��������Ũ����������������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����Ӧ���Ũ�ȣ�����ʹ��ѧ��Ӧ���ʼӿ죻�ٽ����������Ի�ѧƽ���ƶ���Ӱ�죬�κη�Ӧ������һ���Ŀ����ԣ��÷�Ӧ������Ӧ�����������С�ķ�Ӧ��������ѹǿ������ʹ��ѧƽ�������������С������Ӧ�����ƶ����ʿ������ԭ�ϵ�ת���ʣ� ��4�� ����K2MnO4��Һ��ͨ��CO2���壬ʹ��ϵ�����Ի������ԣ���ʱK2MnO4�ᷢ���绯��Ӧ������KMnO4��MnO2�����������غ㶨�ɿ�֪������һ����������KHCO3������������ԭ��Ӧ�еĵ����غ㼰��Ӧ��ԭ���غ㣬�ɵø÷�Ӧ�Ļ�ѧ����ʽ�ǣ�3K2MnO4+ 4CO2+2H2O = 2KMnO4+MnO2+4KHCO3���ڡ���ⷨ��Ϊ�ִ����գ������K2MnO4ˮ��Һ���ڵ�����������MnO42-ʧȥ���ӣ�����������Ӧ������MnO4-�������ĵ缫��Ӧʽ�ǣ�MnO42--e-=MnO4-������������Һ�е�ˮ���������H+��õ��ӱ�Ϊ�����ݳ��������ĵ缫��Ӧʽ�ǣ�2H2O+2e-=H2��+2OH-�����������ݳ���������H2���ܷ�Ӧ����ʽ�ǣ�2K2MnO4+2H2O
2K2MnO4+2H2O ����3������������Ӧ��������״̬����̬������ƽ¯��������ѹǿ���Ϳ���ʹ��Ӧ��������Ũ����������������Ի�ѧ��Ӧ���ʵ�Ӱ�죬����Ӧ���Ũ�ȣ�����ʹ��ѧ��Ӧ���ʼӿ죻�ٽ����������Ի�ѧƽ���ƶ���Ӱ�죬�κη�Ӧ������һ���Ŀ����ԣ��÷�Ӧ������Ӧ�����������С�ķ�Ӧ��������ѹǿ������ʹ��ѧƽ�������������С������Ӧ�����ƶ����ʿ������ԭ�ϵ�ת���ʣ� ��4�� ����K2MnO4��Һ��ͨ��CO2���壬ʹ��ϵ�����Ի������ԣ���ʱK2MnO4�ᷢ���绯��Ӧ������KMnO4��MnO2�����������غ㶨�ɿ�֪������һ����������KHCO3������������ԭ��Ӧ�еĵ����غ㼰��Ӧ��ԭ���غ㣬�ɵø÷�Ӧ�Ļ�ѧ����ʽ�ǣ�3K2MnO4+ 4CO2+2H2O = 2KMnO4+MnO2+4KHCO3���ڡ���ⷨ��Ϊ�ִ����գ������K2MnO4ˮ��Һ���ڵ�����������MnO42-ʧȥ���ӣ�����������Ӧ������MnO4-�������ĵ缫��Ӧʽ�ǣ�MnO42--e-=MnO4-������������Һ�е�ˮ���������H+��õ��ӱ�Ϊ�����ݳ��������ĵ缫��Ӧʽ�ǣ�2H2O+2e-=H2��+2OH-�����������ݳ���������H2���ܷ�Ӧ����ʽ�ǣ�2K2MnO4+2H2O![]() 2KMnO4+2H2��+2KOH������������ⷨ������ʽ2K2MnO4+ 2H2O
2KMnO4+2H2��+2KOH������������ⷨ������ʽ2K2MnO4+ 2H2O![]() 2KMnO4+2H2��+2KOH ��֪K2MnO4��ȫת��ΪKMnO4������K2MnO4��������������100%��������CO2�绯���� 3K2MnO4+ 4CO2+2H2O = 2KMnO4+MnO2+4KHCO3���У���Ӧ��K2MnO4��ֻ��2/3��Ӧת��ΪKMnO4������K2MnO4��������������2/3��������ⷨ������CO2�绯������ȡKMnO4ʱK2MnO4������������֮��Ϊ1:2/3=3:2����5���������ӷ���ʽ2MnO4-+5H2C2O4+ 6H+= 2Mn2++10CO2��+8H2O��֪KMnO4����ᷴӦ�Ĺ�ϵʽ�ǣ�2KMnO4��5H2C2O4��ȡŨ��Ϊ0.2000 mol��L1��H2C2O4����Һ20.00 mL������ϡ�����ữ����KMnO4��Һƽ�еζ����Σ�ƽ�����ĵ����Ϊ24.48 mL�������Ƶ���Һ��Ũ��Ϊ��
2KMnO4+2H2��+2KOH ��֪K2MnO4��ȫת��ΪKMnO4������K2MnO4��������������100%��������CO2�绯���� 3K2MnO4+ 4CO2+2H2O = 2KMnO4+MnO2+4KHCO3���У���Ӧ��K2MnO4��ֻ��2/3��Ӧת��ΪKMnO4������K2MnO4��������������2/3��������ⷨ������CO2�绯������ȡKMnO4ʱK2MnO4������������֮��Ϊ1:2/3=3:2����5���������ӷ���ʽ2MnO4-+5H2C2O4+ 6H+= 2Mn2++10CO2��+8H2O��֪KMnO4����ᷴӦ�Ĺ�ϵʽ�ǣ�2KMnO4��5H2C2O4��ȡŨ��Ϊ0.2000 mol��L1��H2C2O4����Һ20.00 mL������ϡ�����ữ����KMnO4��Һƽ�еζ����Σ�ƽ�����ĵ����Ϊ24.48 mL�������Ƶ���Һ��Ũ��Ϊ��![]() ����1.0800g��Ʒ�к�KMnO4�����ʵ���Ϊ��n��KMnO4��=c��V=
����1.0800g��Ʒ�к�KMnO4�����ʵ���Ϊ��n��KMnO4��=c��V=![]()
![]() ��������Ʒ��������1.0800g�������Ʒ���е�KMnO4�ĵĴ���Ϊ����=
��������Ʒ��������1.0800g�������Ʒ���е�KMnO4�ĵĴ���Ϊ����=![]() ��
��

 ��ĩ�óɼ�ϵ�д�
��ĩ�óɼ�ϵ�д� 99��1������ĩ��ѵ��ϵ�д�
99��1������ĩ��ѵ��ϵ�д� ��ǿ��У��ĩ���100��ϵ�д�
��ǿ��У��ĩ���100��ϵ�д� �óɼ�1��1��ĩ���100��ϵ�д�
�óɼ�1��1��ĩ���100��ϵ�д� ��״Ԫ���źþ�ϵ�д�
��״Ԫ���źþ�ϵ�д�����Ŀ���±�ΪԪ�����ڱ���һ���֣�
�� | ||||||||
1 | �� | |||||||
2 | �� | |||||||
3 | �� | �� | �� | �� | ||||
I. �����Ԫ���������ڱ��е�λ�ã��û�ѧ����ش��������⣺
��1������Ԫ���������ӽṹʾ��ͼ______________��
��2
��3��Ԫ���������γɵĻ�����ĵ���ʽ��____________________��
II. ����������Ԫ����ɵ����ʼ䣬��һ�������£����Է�����ͼ��ʾ�ı仯������A��һ�ֵ���ɫ���塣��ش�
��4��д������A��Һ��X��Ӧ�����ӷ���ʽ ��
��5������Y��һ�ִ�����Ⱦ�ֱ���ŷŻ��γ����ꡣ������ҺB���գ�д��������Y��B
��Һ��Ӧ�����ӷ���ʽ__________________________________________________
��6��������C��Y�ں��ݾ��ȵ������·�Ӧ��������Щ˵��˵���÷�Ӧ�ﵽƽ��״̬��_______
A. �¶Ȳ���
B. 2v����C��=v����Y��
C.���������ܶȲ���
D.��������ƽ����Է�����������
����Ŀ��ƻ����(ACV)��һ����ƻ�����Ͷ��ɵ�������Ʒ�����нⶾ����֬��ҩЧ��ƻ������һ�ֳ������л��ᣬ��ṹ��ʽΪ![]() ��
��
��1��ƻ�����к��еĹ����ŵ�������________��_____________��
��2��ƻ���ķ���ʽΪ__________________��
��3��1 molƻ���������������Ʒ�Ӧ�������ɱ�״���µ�����________L��
��4��ƻ�����ܷ����ķ�Ӧ��________��
A����NaOH��Һ��Ӧ |
B����ʯ����Һ���� |
C����������һ������������ |
D�����Ҵ���һ������������ |