题目内容
9. 汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H>0,已知该反应在2 404℃,平衡常数K=64×10-4.请回答:
汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)?2NO(g)△H>0,已知该反应在2 404℃,平衡常数K=64×10-4.请回答:(1)某温度下,向2L的密闭容器中充入N2和O2各1mol.5分钟后O2的物质的量为0,5mol,则N2的反应速率为0.05mol/(L•min).
(2)为了减少汽车尾气中有害气体的排放,在现实生活中你认为可以采取的措施有CD.
A.采用耐高温的陶瓷发动机,以提高内燃机的工作温度
B.为了避免上述反应,不使用空气,改用纯氧气
C.在排气管中安装高效催化剂,将有害气体转化为无害气体
D.将燃油车改换成电动车
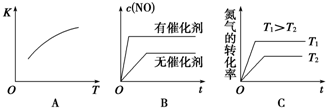
(3)将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是AC(填字母序号).
(4)将一定量的N2、O2混合气体充入恒温密闭容器中,分别在不同的压强P1、P2(P1>P2)下达到平衡,请在答题卷图中画出N2的转化率在不同压强下随时间变化的曲线图(要有相应的标识).
分析 (1)5分钟内,△n(O2)=1mol-0.5mol=0.5mol,由N2(g)+O2(g)?2NO(g)可知△n(N2)=0.5mol,带入v=$\frac{△n}{V•△t}$计算;
(2)A、高温能加快化学反应速率,不能改变反应历程;
B、增大氧气的浓度,N2(g)+O2(g)?2NO(g)的平衡正向移动;
C、在排气管中安装高效催化剂,将NO转化为N2,减少了空气污染;
D、电动车清洁环保,不会产生尾气;
(3)根据温度、催化剂对反应速率和平衡移动的影响判断;
(4)N2(g)+O2(g)?2NO(g)为等体积的反应,压强对化学平衡无影响,增大压强可以加快化学反应速率.
解答 解:(1)5分钟内,△n(O2)=1mol-0.5mol=0.5mol,由N2(g)+O2(g)?2NO(g)可知△n(N2)=0.5mol,v(N2)=$\frac{△n}{V•△t}$=$\frac{0.5mol}{2L×5min}$=0.05mol/(L•min),
故答案为:0.05mol/(L•min);
(2)A、高温能加快化学反应速率,不能改变反应历程,因此不能减少汽车尾气中有害气体的排放,故A错误;
B、改用纯氧气,增大氧气的浓度,N2(g)+O2(g)?2NO(g)的平衡正向移动,产生更多的NO,故B错误;
C、在排气管中安装高效催化剂,将NO转化为N2,减少了空气污染,故C正确;
D、电动车清洁环保,不会产生尾气,故D正确;
故答案为:CD;
(3)A、该反应的正反应为吸热反应,则升高温度平衡向正反应进行,平衡常数增大,故A正确;
B、加入催化剂,反应速率增大,但平衡不发生移动,故B错误;
C、升高温度,反应速率增大,平衡向正反应方向移动,氮气的转化率增大,故C正确;
故答案为:AC;
(4)N2(g)+O2(g)?2NO(g)为等体积的反应,压强对化学平衡无影响,因此平衡时氮气的转化率相等,增大压强可以加快化学反应速率,缩短达到平衡所用的时间,N2的转化率在不同压强下随时间变化的曲线图为: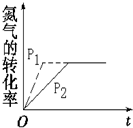 ,故答案为:
,故答案为: .
.
点评 本题考查了化学反应速率的计算、化学平衡的影响因素等知识,题目综合性较强,为高考常见题型,注意化学反应原理的理解和应用.

 名校课堂系列答案
名校课堂系列答案| A. | 升高反应温度 | B. | 及时从平衡混合气体中分离出NH3 | ||
| C. | 使用催化剂 | D. | 减小压强 |
| A. | $\frac{18}{{N}_{A}}$ | B. | $\frac{18g•mo{l}^{-1}}{{N}_{A}}$ | C. | 18NAg | D. | $\frac{18g}{{N}_{A}}$ |
| A. | 红牛配方中有三类物质:一是B族维生素,二是人体必需的氨基酸,三是咖啡因.这些对人体都是有益无害的 | |
| B. | 淀粉和纤维素的化学式均为(C6H10O5)n,二者互为同分异构体 | |
| C. | 乙酸乙酯在碱性条件下水解叫皂化反应 | |
| D. | 蛋白质溶液具有丁达尔效应 |
| A. | 1 L 0.1 mol•L-1的氨水含有0.1NA个OH- | |
| B. | 1 L 1 mol•L-1的NaClO溶液中含有ClO-的数目为NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1 NA | |
| D. | 在电解精炼粗铜的过程中,当阴极析出32 g铜时转移电子数为NA |
| A. | 废旧电池直接填埋 | B. | 废弃的秸秆用于堆肥 | ||
| C. | 聚乙烯塑料露天焚烧 | D. | 玻璃废品回收利用 |
| A. | 赤潮是水体富营养化的结果 | |
| B. | 含磷洗涤剂广泛使用与排放量是发生赤潮的主要原因 | |
| C. | 在封闭的海湾更容易发生赤潮 | |
| D. | 赤潮的发生是与人类活动无关的自然现象 |
| A. | CaCO3═Ca2++CO32- | B. | NaHSO4═Na++HSO4- | ||
| C. | H2CO3?H++HCO3- | D. | NH3•H2O?NH4++OH- |