题目内容
(14分)氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义。
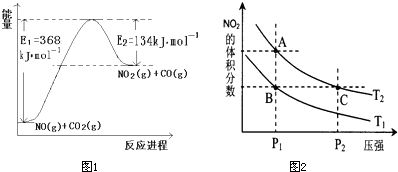
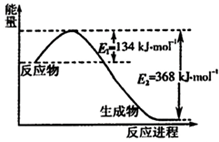
(1)下图是1 molNO2和1 mol CO反应生成CO2和NO过程中能量变化示意图,写出NO2和CO反应的热化学方程式 。(2分)
(2)已知:
N2(g)+O2(g)=2NO(g) △H=+180kJ·mol-1
2NO(g)+2 CO(g)=N2(g)+2 CO2(g)△H=-746 kJ·mol-1
则反应CO(g)+1/2O2(g)=CO2(g)的△H= kJ·mol-1 (2分)
(3)在一固定容积为2L的密闭容器内加人0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应。N2(g)+3H2(g)2NH3(g)△H<0,若第5分钟时达到平衡,此时测得NH3的物质的量为0.2mol,则前5分钟的平均反应速率v(N2)为 ,平衡时H2的转化率为 ,该反应的平衡常数K= 。(6分)
(4)在固定体积的密闭容器中,1.0×103kPa时,反应N2(g)+3H2(g)2NH3(g) △H<0的平衡常数K与温度T的关系如下表:
| T/K | 298 | 398 | 498 |
| 平衡常数K | 51 | K1 | K2 |
则K1 K2(填写“>”、“=”或“<”)(2分)
(5)在体积一定的密闭容器中能说明合成氨反应一定达到平衡状态的是
(填字母)(2分)
a. 容器内N2、H2、NH3的浓度之比为1:3:2 b. NH3的浓度保持不变
c. 容器内压强保持不变 d.. 混合气体的密度保持不变
(1)NO2(g)+CO(g)= CO2(g)+NO(g) △H =-234 kJ·mol-1(2分)
(2)-283 (2分)
(3)0.01 mol•L-1•min-1(2分), 50% (2分) 59.3(2分)
(4)>(2分) (5)b c (2分,少一个扣一分,错选不得分
解析:略

 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.