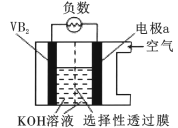
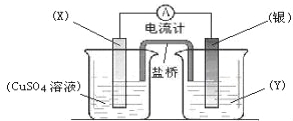
题目内容
【题目】2SO2(g) +O2(g)![]() 2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g)氧化为 lmol SO3(g)的△H =-99kJ·mol-1
2SO3(g)反应过程的能量变化如图所示,已知1mol SO2(g)氧化为 lmol SO3(g)的△H =-99kJ·mol-1

请回答下列问题:
(1)图中C表示_________________,该反应通常用V2O5作催化剂,加V2O5会使图中B点升高还是降低?_______;
(2)图中反应的逆反应活化能为_______________(请用含有E和△H的式子表示);
(3)如果反应速率 v(SO2)为0.06 mol·L-1·min-1,则 v(O2)为______ mol·L-1·min-1
(4)己知 S(s) + O2(g)= SO2(g) △H =-296kJ·mol-1,则由 S(s)生成4 mol SO3(g) 的△H _____kJ·mol-1。
【答案】 生成物能量 降低 E-△H 0.03 -1580
【解析】(1)因图中C表示生成物总能量,该反应通常用V2O5作催化剂,催化剂改变了反应的历程使活化能降低,故加V2O5会使图中B点降低;(2)反应的活化能是使普通分子变成活化分子所需提供的最低限度的能量,依据图象能量关系可知,逆反应的活化能=正反应的活化能+反应的焓变,图中反应的逆反应活化能为:E-△H;(3)根据反应速率之比等于化学计量数之比,如果反应速率 v(SO2)为0.06 mol·L-1·min-1,则 v(O2)=![]() v(SO2)=
v(SO2)=![]() ×0.06mol·L-1·min-1 =0.03 mol·L-1·min-1;(4)已知1mol SO2(g)氧化为 lmol SO3(g)的△H =-99kJ·mol-1 ,则有:①2SO2(g) +O2(g)
×0.06mol·L-1·min-1 =0.03 mol·L-1·min-1;(4)已知1mol SO2(g)氧化为 lmol SO3(g)的△H =-99kJ·mol-1 ,则有:①2SO2(g) +O2(g)![]() 2SO3(g) △H1 =-198kJ·mol-1 ,②S(s) + O2(g)= SO2(g) △H2 =-296kJ·mol-1,根据盖斯定律,由②×4+①×2可得:4S(s) + 6O2(g)= 4SO3(g) △H =2△H1 +4△H2= -1580 kJ·mol-1。
2SO3(g) △H1 =-198kJ·mol-1 ,②S(s) + O2(g)= SO2(g) △H2 =-296kJ·mol-1,根据盖斯定律,由②×4+①×2可得:4S(s) + 6O2(g)= 4SO3(g) △H =2△H1 +4△H2= -1580 kJ·mol-1。

 阅读快车系列答案
阅读快车系列答案