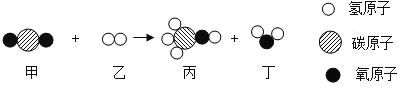
题目内容
【题目】下列化学用语的表达正确的是( )
A. NH4++H2O=NH3·H2O+H+
B. Na2SO3+2H2O![]() 2NaOH+2H2SO3
2NaOH+2H2SO3
C. NaHCO3=Na++H++CO32-
D. BaSO4(s)![]() Ba2+(aq)+SO42-(aq)
Ba2+(aq)+SO42-(aq)
【答案】D
【解析】
A. 铵根水解是可逆的,即NH4++H2O![]() NH3·H2O+H+,A错误;
NH3·H2O+H+,A错误;
B. 亚硫酸根离子水解分步且以第一步水解为主,即Na2SO3+H2O![]() NaOH+NaHSO3,B错误;
NaOH+NaHSO3,B错误;
C. 碳酸氢钠是弱酸的酸式盐,其电离方程式为NaHCO3=Na++HCO3-,C错误;
D. 硫酸钡难溶,存在溶解平衡,即BaSO4(s)![]() Ba2+(aq)+SO42-(aq),D正确。
Ba2+(aq)+SO42-(aq),D正确。
答案选D。

 金钥匙试卷系列答案
金钥匙试卷系列答案【题目】二氯化二硫(S2C12)用作有机化工产品、杀虫剂、硫化染料、合成橡胶等生产中的氯化剂和中间体。S2Cl2是一种有毒并有恶臭气味的浅黄色液体,在300℃以上完全分解,其蒸汽遇水分解,易溶解硫磺;将适量氯气通入熔融的硫磺而得,过量的Cl2会将S2Cl2进一步氧化得到SCl2。以下是对S2Cl2的制备及研究,请回答下列问题:
Ⅰ.S2Cl2的制备
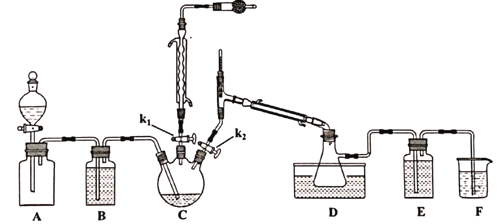
已知,各物质的熔沸点如下:
物质 | S | S2Cl2 | SCl2 |
沸点/℃ | 445 | 138 | 59 |
熔点/℃ | 113 | -76 | -122 |
制备的流程为:
①A装置集气瓶中充满Cl2,打开A装置中的分液漏斗,打开k1、k2,一段时间后关闭k2。
②接通冷凝水,将C加热至135~140℃。
③一段时间后关闭k1,同时打开k2,最后在D中收集到浅黄色液体。
(1)实验室制取氯气的反应方程式_________________________________。
(2)A装置分液漏斗中盛装的液体是___________。
A.CCl4 B.饱和NaHCO3溶液 C饱和NaCl溶液
(3)滴加过程要缓慢,原因是____________________________________________。
(4)D装置中水浴温度应控制为___________,原因是_______________________________。
Ⅱ.S2Cl2纯度的测定
已知:S2Cl2遇水分解的化学方程式:2S2Cl2+2H2O=3S↓+SO2↑+4HCl,取agⅡ中黄色液体于锥形瓶,加水至反应完全(假设杂质均不与水反应),向所得液中加入过量的C0 mol/L的AgNO3溶液V0mL。再向锥形瓶中加入硝基苯,将生成的沉淀覆盖。加入适量Fe(NO3)3作指示剂,用C1 mol/L NaSCN溶液滴定至终点,消耗 NaSCN溶液V1mL(滴定过程发生反应:Ag++SCN-= AgSCN↓)
(5)滴定终点的现象为_________________________________。
(6)S2Cl2的纯度为___________(写出表达式);若滴定过程中未加硝基苯,则所得纯度___________。(填“偏大”、“偏小”、“无影响”)
【题目】下表为元素周期表的一部分,根据表中序号对应元素回答有关问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)表中元素,化学性质最不活泼的是___,只有负价而无正价的是___,原子半径最大的是___;(填写元素符号);
(2)表中能形成两性氢氧化物的元素是___(填元素符号),分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的离子方程式分别是___、___。
(3)元素①组成的单质的电子式为___;用电子式表示⑥的氢化物的形成过程___。
(4)②和③的单质加热时反应生成物质X,其化学式为___,该物质中含有的化学键的类型为___。