题目内容
【题目】分B、C、D、E、F 是原子序数依次增大的短周期主族元素,B 是短周期中金属性最强的 元素,C 是同周期中离子半径最小的元素,D 元素的最高价氧化物对应水化物与 B 元素的最高 价氧化物对应水化物反应的产物 M 是制备木材防火剂的原料,E 的最外层电子数与内层电子数 之比为 3﹕5。请回答:
(1)D 的原子结构示意图为___________________。
(2)写出工业制 F 单质的化学方程式:___________________。
(3)用电子式表示元素 B 与元素 F 形成的化合物:___________________。
(4)B单质与氧气反 应的产物与 C 的单质同时放入水中,产生两种无色气体,有关的化学方程式为____________________、___________________。
(5)写出 M 与盐酸反应的离子方程式:___________________。
(6)工业上将干燥的 F 单质通入熔融的 E 单质中可制得化合物 E2F2,该物质可与水反应生成 一种能使品红溶液褪色的气体,0.2mol 该物质参加反应时转移 0.3mol 电子,其中只有一种元素化合价发生改变,该反应的化学方程式为___________________。
【答案】(1)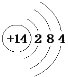 ;
;
(2)2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(3)![]() ;
;
(4)2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(5)SiO32-+2H+=H2SiO3↓;
(6)2S2Cl2+2H2O═3S↓+SO2↑+4HCl。
【解析】试题分析:B是短周期中金属性最强的元素,则B为Na;而B、C、D、E、F是原子序数依次增大的短周期主族元素,元素均处于第三周期,C是同周期中离子半径最小的元素,则C为Al;D元素的最高价氧化物对应水化物与B元素的最高价氧化物对应水化物反应的产物M是制备木材防火剂的原料,则D为Si,M为Na2SiO3,E的最外层电子数与内层电子数之比为3﹕5,则最外层电子数为6,故E为S元素,则F为Cl元素。
(1)D为Si元素,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)工业制氯气的化学方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O
2NaOH+H2↑+Cl2↑,故答案为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
(3)元素B与元素F形成的化合物为NaCl,其电子式为:![]() ,故答案为:
,故答案为:![]() ;
;
(4)Na与氧气反应的产物与Al单质同时放入水中,产生两种无色气体,应是过氧化钠与水反应生成氢氧化钠与氧气,氢氧化钠与Al反应生成偏铝酸钠与氢气,有关的化学方程式为:2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,故答案为:2Na2O2+2H2O═4NaOH+O2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑;
(5)Na2SiO3与盐酸反应的离子方程式:SiO32-+2H+=H2SiO3↓,故答案为:SiO32-+2H+=H2SiO3↓;
(6)工化合物S2Cl2可与水反应生成一种能使品红溶液褪色的气体,该气体为SO2,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,故S元素化合价降低,转移0.3mol电子生成二氧化硫为0.1mol,故有0.3molS原子发生还原反应,根据电子转移守恒可知S元素在还原产物中的化合价为0,故生成S,同时生成HCl,该反应的化学方程式为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl,故答案为:2S2Cl2+2H2O═3S↓+SO2↑+4HCl。

 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案