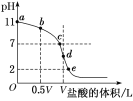
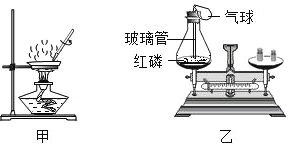
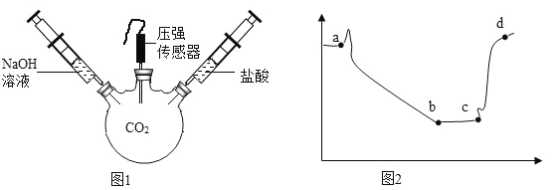
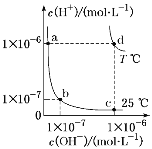题目内容
【题目】下表为元素周期表的一部分,根据表中序号对应元素回答有关问题:
族 周期 | IA | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
4 | ⑨ | ⑩ |
(1)表中元素,化学性质最不活泼的是___,只有负价而无正价的是___,原子半径最大的是___;(填写元素符号);
(2)表中能形成两性氢氧化物的元素是___(填元素符号),分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的离子方程式分别是___、___。
(3)元素①组成的单质的电子式为___;用电子式表示⑥的氢化物的形成过程___。
(4)②和③的单质加热时反应生成物质X,其化学式为___,该物质中含有的化学键的类型为___。
【答案】Ar O K Al Al(OH)3+3H+=Al3++3H2O Al(OH)3+OH-=AlO2-+2H2O ![]()
![]() Na2O2 离子键、非极性共价键
Na2O2 离子键、非极性共价键
【解析】
根据元素在周期表中的位置可知①为N元素,②为O元素,③为Na元素,④为Al元素,⑤为Si元素,⑥为S元素,⑦为Cl元素,⑧为Ar元素,⑨为K元素,⑩为Br元素,结合元素在周期表中的位置以及元素周期律的递变规律可解答该题。
(1)稀有气体性质最不活泼,所以化学性质最不活泼的是Ar;O元素一般只有负化合价,没有正化合价;同周期从左到右原子半径逐渐减小,同一主族从上到下原子半径逐渐增大,所以前四周期中原子半径最大的是K元素;
(2)Al元素能形成两性氢氧化物,⑥⑨最高价氧化物的水化物反应分别是KOH、H2SO4,反应方程式分别为Al(OH)3+KOH=NaAlO2+2H2O、2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,离子方程式分别为:Al(OH)3+3H+=Al3++3H2O ;Al(OH)3+OH-=AlO2-+2H2O;
(3)元素①组成的单质是N2,电子式为:![]() ,⑥的氢化物是H2S,用电子式表示其形成过程为:
,⑥的氢化物是H2S,用电子式表示其形成过程为:![]() ;
;
(4)②和③的单质分别是钠和氧气,在加热条件下生成物质为Na2O2;由钠离子和过氧根形成的离子化合物,钠离子和过氧根间有离子键,过氧根内有非极性共价键。