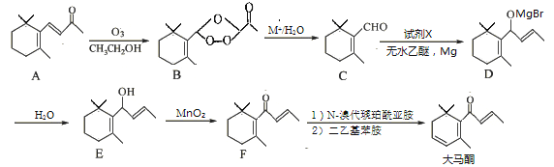
题目内容
【题目】碳及其化合物在工农业上有重要作用。
(1)水煤气是将水蒸气通过灼热的焦炭而生成的气体,水煤气的主要成分为_________
(用化学式表示);
(2)高温时,用CO还原MgSO4可制备高纯度MgO。若在750℃时,测得气体中含有等物质的量的SO2、SO3,则反应的化学方程式为____________;
(3)二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。科学家提出由CO2制取碳的太阳能工艺如右图所示。

①若“重整系统”发生的反应中![]() =6,则FexOy的化学式为____________;
=6,则FexOy的化学式为____________;
②“热分解系统”中每分解1mol FexOy,转移电子的物质的量为____________。
(4)工业上用CO2和H2反应合成甲醚。
已知:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) ΔH=130.8 kJ·mol-1
CH3OCH3(g)+3H2O(g) ΔH=130.8 kJ·mol-1
①一定条件下,上述合成甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是____________(填标号)。
a.逆反应速率先增大后减小 b.反应物的体积百分含量减小
c.H2的转化率增大 d.容器中的n(CO2)/n(H2)值变小
②某压强下,合成甲醚的反应在不同温度、不同投料比时,CO2的转化率如图所示。

T1温度下,将4molCO2和8molH2充入2L的密闭容器中,5min后该反应达到平衡,则0~5min内的平均反应速率v(CH3OCH3)=______________;
KA、KB、KC三者之间的大小关系为_____________。
(5)常温下,用氨水吸收CO2可得到NH4HCO3溶液,在该溶液中,c(NH4+)________(填“>”、“<”或“=”)c(HCO3-;反应NH4++HCO3+H2O![]() NH3·H2O+H2CO3的平衡常数K=__________。
NH3·H2O+H2CO3的平衡常数K=__________。
(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数K1=4×10-7,K2=4×10-11)
【答案】 CO、H2 2MgSO4 + CO![]() 2MgO + SO2 +SO3 +CO2 Fe3O4 2mol c 0.12mol·L-1·min-1 KA=KC>KB > 1.25×10-3
2MgO + SO2 +SO3 +CO2 Fe3O4 2mol c 0.12mol·L-1·min-1 KA=KC>KB > 1.25×10-3
【解析】(1)水煤气的主要成分为CO、H2;(2)高温时,用CO还原MgSO4可制备高纯度MgO,同时还有CO2生成。若在750℃时,测得气体中含有等物质的量的SO2、SO3,则根据原子守恒可知反应的化学方程式为2MgSO4 + CO![]() 2MgO + SO2 +SO3 +CO2;(3)①根据流程知“重整系统”氧化亚铁和二氧化碳反应生成铁的氧化物和碳,当氧化亚铁和二氧化碳的物质的量之比为6时根据原子守恒确定FexOy的化学式为Fe3O4。②四氧化三铁分解的方程式为Fe3O4=3FeO+1/2O2↑,因此“热分解系统”中每分解1mol FexOy,生成0.5mol氧气,转移电子的物质的量为2mol。(4)①a.增大生成物的浓度,逆反应速率先增大后减小,平衡逆向移动,a错误;b.减小反应物的浓度,反应物的体积百分含量减小,平衡逆向移动,b错误;c.H2的转化率增大,平衡一定向正反应方向移动,c正确;d.减小二氧化碳的浓度,平衡逆向移动,容器中的
2MgO + SO2 +SO3 +CO2;(3)①根据流程知“重整系统”氧化亚铁和二氧化碳反应生成铁的氧化物和碳,当氧化亚铁和二氧化碳的物质的量之比为6时根据原子守恒确定FexOy的化学式为Fe3O4。②四氧化三铁分解的方程式为Fe3O4=3FeO+1/2O2↑,因此“热分解系统”中每分解1mol FexOy,生成0.5mol氧气,转移电子的物质的量为2mol。(4)①a.增大生成物的浓度,逆反应速率先增大后减小,平衡逆向移动,a错误;b.减小反应物的浓度,反应物的体积百分含量减小,平衡逆向移动,b错误;c.H2的转化率增大,平衡一定向正反应方向移动,c正确;d.减小二氧化碳的浓度,平衡逆向移动,容器中的![]() 值变小,d错误,答案选c。②分析图像知T1温度下,将4mol CO2和8mol H2充入2 L的密闭容器中,5 min后反应达到平衡,CO2的转化率为60%,则参加反应的二氧化碳的物质的量为2.4mol,生成二甲醚的物质的量为1.2mol,则0~5 min内的平均反应速率v (CH3OCH3) =1.2mol÷(2L×5min)=0.12mol/(L·min);③合成二甲醚的反应为放热反应,升高温度平衡向逆反应方向进行,CO2的转化率降低,因此温度T2大于T1。平衡常数只与温度有关系,则KA、KB、KC三者之间的大小关系为KA=KC>KB ;(5)分析题给电离常数知一水合氨的电离程度大于碳酸的一级电离程度,则碳酸氢根的水解程度大于铵离子的水解程度,则NH4HCO3溶液中,c(NH4+)>c(HCO3-);反应NH4++HCO3-+H2O
值变小,d错误,答案选c。②分析图像知T1温度下,将4mol CO2和8mol H2充入2 L的密闭容器中,5 min后反应达到平衡,CO2的转化率为60%,则参加反应的二氧化碳的物质的量为2.4mol,生成二甲醚的物质的量为1.2mol,则0~5 min内的平均反应速率v (CH3OCH3) =1.2mol÷(2L×5min)=0.12mol/(L·min);③合成二甲醚的反应为放热反应,升高温度平衡向逆反应方向进行,CO2的转化率降低,因此温度T2大于T1。平衡常数只与温度有关系,则KA、KB、KC三者之间的大小关系为KA=KC>KB ;(5)分析题给电离常数知一水合氨的电离程度大于碳酸的一级电离程度,则碳酸氢根的水解程度大于铵离子的水解程度,则NH4HCO3溶液中,c(NH4+)>c(HCO3-);反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=Kw/KbK1=1.25×10-3。
NH3·H2O+H2CO3的平衡常数K=Kw/KbK1=1.25×10-3。

 阅读快车系列答案
阅读快车系列答案