题目内容
【题目】钼(Mo)是一种过渡金属元素,通常用作合金及不锈钢的添加剂。钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠及制备金属钼的主要流程图如图所示:
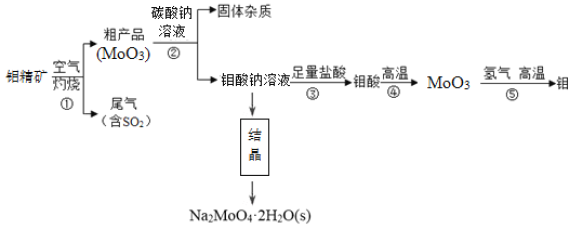
(1)Na2MoO4·2H2O中钼元素的化合价是____。结晶得到的钼酸钠晶体是粗产品,要得到纯净的钼酸钠晶体,下一步需要进行的操作是________(填名称)。
(2)灼烧过程中钼精矿发生的主要反应的化学方程式为MoS2+O2→MoO3+SO2(未配平),该反应中氧化产物是__________(填化学式);若反应中生成36.0 g MoO3,反应中转移电子的数目为______。
(3)尾气中含有SO2需要处理,下列不能用作吸收剂的是 (填序号)。
a. Ca(OH)2 b. HNO3 c. Na2CO3
(4)加入Na2CO3溶液时发生反应的化学方程式为_______________________。
能提高该反应速率的措施有_______(填序号)。
a.将粗产品粉碎 b.降低碳酸钠溶液的浓度 c.适当升高温度
(5)利用铝热反应也可回收金属钼,写出MoO3发生铝热反应的化学方程式________________。
(6)已知钼酸钠溶液中c(![]() )=0.40 mol·L1,c(
)=0.40 mol·L1,c(![]() )=0.52 mol·L1。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去
)=0.52 mol·L1。由钼酸钠溶液制备钼酸钠晶体时,需加入Ba(OH)2固体以除去![]() 。当BaMoO4开始沉淀时,
。当BaMoO4开始沉淀时,![]() 的去除率是_______。[已知Ksp(BaCO3)=2.6×109、Ksp(BaMoO4)=4.0×108,忽略溶液的体积变化]
的去除率是_______。[已知Ksp(BaCO3)=2.6×109、Ksp(BaMoO4)=4.0×108,忽略溶液的体积变化]
【答案】
(1)+6(1分) 重结晶(1分)
(2)MoO3、SO2(2分) 3.5NA(2分)
(3)b(1分)
(4)MoO3+Na2CO3=Na2MoO4+CO2↑(2分) ac(2分)
(5)4Al+2MoO3![]() 2Mo+2Al2O3(2分)
2Mo+2Al2O3(2分)
(6)95%(2分)
【解析】
试题分析:
(1)根据正负价代数和为0可知Na2MoO4·2H2O中钼元素的化合价是+6价。结晶得到的钼酸钠晶体是粗产品,要得到纯净的钼酸钠晶体,需要进行的操作是重结晶。
(2)根据方程式可知Mo、S元素的化合价分别从+4价、2价升高到+6价、+4价,因此该反应中氧化产物是MoO3、SO2;36.0 g MoO3是0.25 mol,1 mol MoS2失去14 mol电子,同时得到1 mol MoO3,因此若反应中生成36.0 g MoO3,转移电子的数目为3.5NA。
(3)氢氧化钙和碳酸钠均能与SO2反应,硝酸虽然可以吸收SO2,但同时产生NO或NO2而污染大气,不能用作吸收剂。
(4)加入Na2CO3溶液时发生反应的化学方程式为MoO3+Na2CO3![]() Na2MoO4+CO2↑。能提高该反应速率的措施有将粗产品粉碎或适当升高温度。降低碳酸钠溶液的浓度会减小反应速率。
Na2MoO4+CO2↑。能提高该反应速率的措施有将粗产品粉碎或适当升高温度。降低碳酸钠溶液的浓度会减小反应速率。
(5)MoO3发生铝热反应的化学方程式为4Al+2MoO3![]() 2Mo+2Al2O3。
2Mo+2Al2O3。
(6)当BaMoO4开始沉淀时,溶液中的碳酸根浓度是![]() ,所以
,所以![]() 的去除率是
的去除率是![]() 。
。