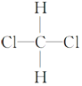
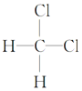
题目内容
【题目】试写出下列反应的离子方程式。
(1)氯化亚铁溶液中加入稀硝酸:______________________________________。
(2)氯化亚铁溶液中加入过氧化氢:________________________________。
(3)用酸性KMnO4标准溶液滴定莫尔盐[FeSO4(NH4)2SO4·xH2O]溶液:___________________________。
(4)硫酸亚铁溶液中加入次氯酸钠溶液:_____________________________。
(5)用酸性重铬酸钾(K2Cr2O7)溶液滴定硫酸亚铁溶液:_________________________。
【答案】3Fe2++4H++NO3-=3Fe3++NO↑+2H2O 2Fe2++2H++H2O2=2Fe3++2H2O ![]()
![]()
![]()
【解析】
(1`)亚铁离子被氧化产生铁离子,同时产生一氧化氮和水,根据电荷守恒以及质量守恒即可配平离子方程式;
(2)在酸性条件下H2O2将Fe2+氧化为Fe3+,H2O2被还原产生H2O;
(3)用酸性KMnO4标准溶液滴定莫尔盐,亚铁离子被氧化产生铁离子,MnO4-被还原产生Mn2+;
(4)亚铁离子被氧化产生铁离子,ClO-被还原产生Cl-,同时产生H2O;
(1)Fe2+失去电子变为Fe3+,元素化合价升高1价,NO3-得到电子变为NO,元素化合价由+5降低到+2,降低3价,升降最小公倍数是3,所以Fe2+、Fe3+系数是3,NO3-、NO系数是1,结合电荷守恒,可知H+的系数是4,根据原子守恒,可知H2O的系数是2,方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O;
(2)氯化亚铁溶液中加入过氧化氢,Fe2+失去电子变为Fe3+,H2O2被还原产生H2O,反应离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O;
(3)用酸性KMnO4标准溶液滴定莫尔盐,亚铁离子被氧化产生铁离子,MnO4-被还原产生Mn2+,离子方程式为:![]() ;
;
(4)硫酸亚铁溶液中加入次氯酸钠溶液,HClO可以氧化Fe2+生成Fe3+,ClO-被还原产生Cl-,同时产生H2O,离子方程式为:![]() ;
;
(5)用酸性重铬酸钾(K2Cr2O7)溶液滴定硫酸亚铁溶液,重铬酸钾氧化Fe2+生成Fe3+,Cr2O72-被还原产生Cr3+,反应的离子方程式为:![]() 。
。

 世纪百通期末金卷系列答案
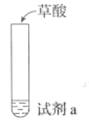
世纪百通期末金卷系列答案【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O