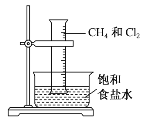
题目内容
【题目】对于可逆反应4NH3+5O2![]() 4NO+6H2O(g),下列叙述正确的是( )
4NO+6H2O(g),下列叙述正确的是( )
A.达到平衡状态,2 v正(NH3)= 3v逆(H2O)
B.反应达到平衡时,反应物的转化率一定小于100%
C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D.单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
【答案】B
【解析】
A.反应速率之比等于方程式的系数之比,v正(NH3):v逆(H2O)=2:3,即3v正(NH3)=2v逆(H2O)时说明化学反应的正、逆反应速率是相等的,达到了化学平衡状态,故A错误;
B.可逆反应不能进行到底,即任何时候,反应物的转化率都小于100%,故B正确;
C.若增加容器体积,相当于减小压强,各物质的浓度均减小,正、逆反应速率都减小,故C错误;
D.单位时间内生成xmolNO,同时消耗xmolNH3,只表示了正反应方向,不能说明化学反应的正、逆反应速率是相等的,故D错误;
故答案为B。

 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案【题目】下表为元素周期表的一部分。
碳 | W | Y | |
X | 硫 | Z |
回答下列问题:
(1)表中元素原子半径最大的是___(写元素符号),Z原子核外电子能量最高的电子亚层是____。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是_____。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)W的氢化物与F2反应,生成一种铵盐与化合物WF3,WF3的分子构型为三角锥形。
①WF3分子为___〔填“极性”或“非极性”)分子。
②写出该反应的化学方程式,配平并标出电子转移的方向和数目:_____。
(4)硫酸工业生产中接触室内发生的反应方程式为_______;在实际生产中,操作温度选定400~500℃、压强通常采用常压的原因分别是_____。