题目内容
3.新型电池在飞速发展的信息技术中发挥着越来越重要的作用.Li2MSiO4(M=Mn、Fe、Co等)是极具发展潜力的新型锂离子电池电极材料,在苹果的几款最新型的产品中已经有了一定程度的应用.下面列出了两种制备Li2FeSiO4的方法:固相法:2Li2SiO3+FeSO4$\frac{\underline{\;惰性气体\;}}{高温}$Li2FeSiO4+Li2SO4+SiO2
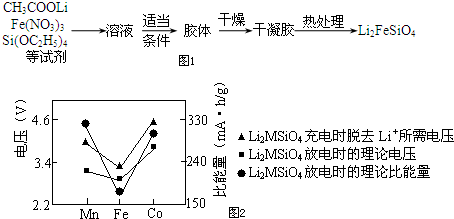
溶胶-凝胶法:如图1
(1)固相法中制备Li2FeSiO4的过程必须在惰性气体氛围中进行,其原因是防止二价铁被氧化;根据已有信息,以下判断正确的是③.
①该反应是氧化还原反应 ②该反应一定是吸热反应
③Li2SiO3 和Li2FeSiO4属于硅酸盐
(2)溶胶-凝胶法中,检验溶液中有胶体产生的方法是取少量液体,用一束强光光线照射,有丁达尔现象;实验中若制得1mol Li2FeSiO4,整个反应过程中转移电子的物质的量为1mol.
(3)以Li2FeSiO4、嵌有Li的石墨为电极,含Li+的导电固体为电解质的锂离子电池,充、放电的总反应式可表示为Li2FeSiO4$?_{放电}^{充电}$Li+LiFeSiO4,该电池放电时,负极是Li,正极反应为LiFeSiO4+Li++e-=Li2FeSiO4 .
(4)三种Li2MSiO4的性能对比如图2所示.实际应用时,常用来源丰富的铁元素生产的Li2FeSiO4作电极材料,使用该电极材料的另一个优点是Li2FeSiO4 充电时脱去Li+所需电压低.
分析 (1)依据亚铁离子具有还原性分析;根据反应2Li2SiO3+FeSO4$\frac{\underline{\;惰性气体\;}}{高温}$Li2FeSiO4+Li2SO4+SiO2可知,反应中各元素化合价没有变化,也无法判断反应的执效应,但Li2SiO3 和Li2FeSiO4都属于硅酸盐,据此答题;
(2)依据胶体的特征性质分析设计实验验证,依据溶胶-凝胶法中铁元素守恒,铁元素化合价从+3价变化为+2价,根据化合价的变化分析;
(3)放电时原电池反应,正极上是得到电子发生还原反应,电池反应中元素化合价降低得到电子,依据总反应式分析判断;
(4)依据图象变化意义分析;
解答 解:(1)固相法中制备Li2FeSiO4的过程必须在惰性气体氛围中进行,因为亚铁离子具有还原性,易被氧化,所以惰性气体氛围中是为了防止亚铁离子被氧化,根据反应2Li2SiO3+FeSO4$\frac{\underline{\;惰性气体\;}}{高温}$Li2FeSiO4+Li2SO4+SiO2可知,反应中各元素化合价没有变化,也无法判断反应的执效应,但Li2SiO3 和Li2FeSiO4都属于硅酸盐,故③正确,
故答案为:防止二价铁被氧化;③;
(2)胶体具有丁达尔现象,取少量液体,用一束强光光线照射,有丁达尔现象证明是胶体;胶-凝胶法中铁元素守恒,铁元素化合价从+3价变化为+2价,若制得1mol Li2FeSiO4,电子转移1mol,
故答案为:取少量液体,用一束强光光线照射,有丁达尔现象;1mol;
(3)总反应式可表示为Li2FeSiO4$?_{放电}^{充电}$Li+LiFeSiO4,放电过程中是原电池反应,Li做负极失电子发生氧化反应,LiFeSiO4在正极上得到电子发生还原反应,电极反应为LiFeSiO4+Li++e-=Li2FeSiO4,
故答案为:Li;LiFeSiO4+Li++e-=Li2FeSiO4 ;
(4)实际应用时,常用铁元素来源丰富的Li2FeSiO4作电极材料,分析图象变化可知,使用该电极材料的另一个优点是Li2FeSiO4 充电时脱去Li+所需电压低,
故答案为:Li2FeSiO4 充电时脱去Li+所需电压低.
点评 本题考查了物质制备实验分析判断、氧化还原反应、原电池原理的应用等,注意氧化还原反应分析和电子转移计算应用,原电池反应和电极反应书写,图象分析判断是关键,题目难度中等.

 通城学典默写能手系列答案
通城学典默写能手系列答案| A. | 0.4mol | B. | 大于0.2mol小于0.4mol | ||
| C. | 0.2mol | D. | 小于0.2mol |
| A. | 化学反应速率是指某一时刻,某种反应物的瞬时反应速率 | |
| B. | 化学反应速率为0.8mol•L-1•s-1是指反应1 s时某物质的浓度为0.8mol•L-1 | |
| C. | 对于一个化学反应来说,其反应速率越大,反应现象就越明显 | |
| D. | 根据化学反应速率的大小可以推知化学反应进行的快慢 |
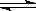 I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大
I2+I-,向盛有KI3溶液的试管中加入适量CCl4,振荡静置后CCl4层显紫色,说明KI3在CCl4中的溶解度比在水中的大 l﹣>I2>Br2>Cl2 B.还原性:Cl﹣>I2>Cl2>Br2
l﹣>I2>Br2>Cl2 B.还原性:Cl﹣>I2>Cl2>Br2