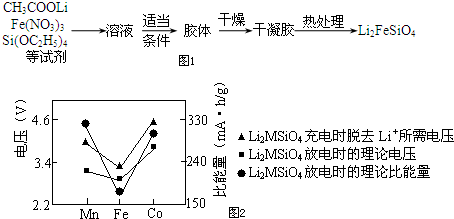
题目内容
13.一瓶溶液里可能含有Mg2+、Na+、OH-、Cl-、CO32- 和SO42-某几种.现分别取该溶液少量装于两支试管,进行以下实验:①向第一支试管中滴入酚酞试液,溶液变红.
②向第二支试管中加入足量BaCl 2溶液,生成白色沉淀.过滤,并将滤液移入第三支试管,在沉淀中加入稀硝酸,沉淀逐渐消失并有无色无味气体产生,该气体通入澄清石灰水,石灰水变浑浊.
③向第三支试管中先加入硝酸酸化,再加入硝酸银溶液,出现白色沉淀.
通过以上实验可判断溶液中含有的离子为Na+、OH-、CO32-,不含有的离子为Mg2+、SO42-,无法确定是否含有的离子为Cl-.写出实验②、③中有关反应的离子方程式:CO32-+Ba2+=BaCO3↓、BaCO3+2H+=Ba2++CO2↑+H2O、Ag++Cl-=AgCl↓.
分析 ①向第一支试管中滴入酚酞试液,溶液变红,说明溶液呈碱性,一定存在大量的OH-,结合离子共存可知一定不存在Mg2+;
②向第二支试管中加入足量BaCl2溶液,生成白色沉淀,可能含有CO32-、SO42-;过滤,并将滤液移入第三支试管,在沉淀中加入稀硝酸,沉淀逐渐消失并有无色无味气体产生,该气体通入澄清石灰水,石灰水变浑浊,则白色沉淀为碳酸钡,一定存在CO32-,一定不存在SO42-;
③向第三支试管中先加入硝酸酸化,再加入硝酸银溶液,出现白色沉淀,该白色沉淀为AgCl,由于②中加入了氯化钡溶液,则无法确定原溶液中是否含有Cl-;
由于溶液为电中性,则一定存在Na+,据此进行解答.
解答 解:根据①向可知溶液呈碱性,一定存在大量的OH-,结合离子共存可知一定不存在Mg2+;
根据②可知溶液中可能含有CO32-、SO42-;过滤,并将滤液移入第三支试管,在沉淀中加入稀硝酸,沉淀逐渐消失并有无色无味气体产生,该气体通入澄清石灰水,石灰水变浑浊,则白色沉淀为碳酸钡,一定存在CO32-,一定不存在SO42-;
③由于②中加入了氯化钡溶液,则无法确定原溶液中是否含有Cl-;
由于溶液为电中性,则一定存在Na+,
根据分析可知,原溶液中一定存在的离子为:Na+、OH-、CO32-,一定不存在的离子为:Mg2+、SO42-,无法确定是否含有Cl-;
②中发生反应的离子方程式为:CO32-+Ba2+=BaCO3↓、BaCO3+2H+=Ba2++CO2↑+H2O,
反应③中银离子与氯离子反应生成氯化银沉淀,离子方程式为:Ag++Cl-=AgCl↓,
故答案为:Na+、OH-、CO32-;Mg2+、SO42-;Cl-;CO32-+Ba2+=BaCO3↓、BaCO3+2H+=Ba2++CO2↑+H2O、Ag++Cl-=AgCl↓.
点评 本题考查了常见离子的检验、离子共存的应用,题目难度中等,明确常见离子的性质及检验方法为解答关键,注意掌握离子反应发生条件及应用方法,试题培养了学生的分析能力及逻辑推理能力.

| A. | 化学反应分为:氧化还原反应、非氧化还原反应(标准:是否有电子的转移) | |
| B. | 分散系分为:溶液、胶体、浊液(标准:能否产生丁达尔效应) | |
| C. | 纯净物分为:单质、化合物(标准:组成物质的元素种数) | |
| D. | 化合物分为:电解质、非电解质(标准:溶于水或熔融状态能否导电的化合物) |
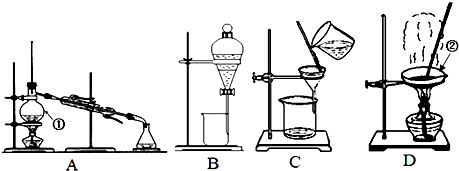
| A. | 用玻璃棒蘸取某种浓度的NaOH溶液点在湿润的pH试纸上测该溶液的pH值 | |
| B. | 用加热蒸发溶剂的方法可以由10%稀盐酸获得的20%浓盐酸 | |
| C. | 向碘水中加入CCl4,振荡静置后分层,CCl4层呈紫色,说明可用CCl4从碘水中萃取碘 | |
| D. | 做蒸馏实验时,为节约用水,应先点燃酒精灯加热再通冷却水 |
| A. | Cu2+ K+ Na+ SO42- | B. | K+ Na+ Cl-HCO3- | ||
| C. | Cl- NO3- Mg2+ NH4+ | D. | NO3- Na+ Cl-K+ |
| A. | 过氧化钠的电子式: | |
| B. | 质子数为35、中子数为45的溴原子:${\;}_{35}^{80}$Br | |
| C. | 硫离子的结构示意图: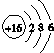 | |
| D. | 福尔马林可作食品的保鲜剂 |