题目内容
8.实验室可用氯气与金属铁反应制备纯净的无水三氯化铁,该化合物易潮解,100℃左右时升华.下图是所做实验的气体流向示意图.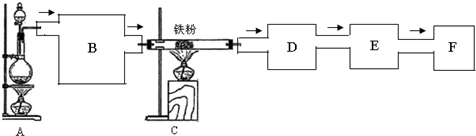
试回答:(1)A中发生反应的离子方程式为:4H++2Cl-+MnO2$\frac{\underline{\;\;△\;\;}}{\;}$Cl2↑+2H2O+Mn2+;
(2)实验过程中,使用分流漏斗滴加浓盐酸的操作是打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加浓盐酸;
(3)C中的反应开始前,需排除装置中的空气,判断C中反应可以开始的依据是:
黄绿色气体充满装置C时,再开始加热C.
(4)B为净化氯气的组合装置,请在下列方框中画出B中的实验装置图并标明试剂名称.

(5)装置D的作用是:收集固体FeCl3,检验其中物质的方法是取少量产物溶于适量蒸馏水中,滴加KSCN溶液,显红色.
(6)装置E中盛放的试剂是:浓H2SO4,其作用是防止F装置中的水气进入D中;
(7)装置F中盛放的试剂是:NaOH溶液,其作用是吸收多余Cl2,防止污染空气.
分析 (1)浓盐酸和二氧化锰反应生成氯化锰、氯气和水,根据离子方程式的书写方法书写;
(2)根据分液漏斗的使用方法:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加液体;
(3)可以用生成的氯气排除装置中的空气,根据黄绿色气体充满装置C时,再开始加热C;
(4)二氧化锰与浓盐酸反应制得氯气中含氯化氢和水蒸气,故采用洗气法除去其中杂质,可以用浓硫酸吸水,用饱和食盐水吸收氯化氢;
(5)根据无水三氯化铁在100℃左右时升华来解答;根据Fe3+在溶液中遇到KSCN溶液作用生成红色物质来检验;
(6)无水三氯化铁易潮解,需要防止F装置中的水气进入;
(7)氯气有毒,实验过程中需要尾气处理.
解答 解:(1)浓盐酸和二氧化锰在加热条件下能发生反应生成氯化锰、氯气、水,方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2 ↑+2H2O,离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++
Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)使用分液漏斗滴加浓盐酸的操作是:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加浓盐酸;
故答案为:打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,缓慢滴加浓盐酸;
(3)A处是制取氯气,C处是氯气和铁反应,所以先点A处酒精灯,使制取的Cl2排尽装置内的空气,一旦黄绿色气体充满装置C时,再开始加热C;
故答案为:黄绿色气体充满装置C时,再开始加热C;
(4)二氧化锰与浓盐酸反应制得氯气中含氯化氢和水蒸气,先用饱和食盐水除去氯气中的氯化氢,再用浓硫酸干燥.装置图如下: ;
;
故答案为: ;
;
(5)无水三氯化铁在100℃左右时升华,所以装置D的作用是收集固体FeCl3,为了检验上述产物,可取少量产物溶于适量蒸馏水中,滴加KSCN溶液,显红色;
故答案为:收集固体FeCl3;取少量产物溶于适量蒸馏水中,滴加KSCN溶液,显红色;
(6)无水三氯化铁易潮解,为了防止F装置中的水气进入,装置E中盛放的试剂是浓H2SO4,
故答案为:浓H2SO4;防止F装置中的水气进入D中;
(7)氯气有毒,实验过程中需要用NaOH溶液吸收多余Cl2,防止污染空气;
故答案为:NaOH溶液;吸收多余Cl2,防止污染空气.
点评 本题以氯化铁的制备为环境,考查了氯气的制备和性质的检验,解题关键理在于明确实验原理和目的及各装置的作用,题目难度中等.

①硫酸铜固体 ②KNO3溶液 ③氯化钾溶液 ④CH3COONa固体 ⑤同浓度的硫酸.
| A. | ①⑤ | B. | ③④ | C. | ②③ | D. | ②④ |
| A. | TiCl4溶于大量水加热制备TiO2 | |
| B. | 热的纯碱溶液用于清洗油污 | |
| C. | 次氯酸钠常用作消毒剂 | |
| D. | FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体 |
| A. | Cu2+ K+ Na+ SO42- | B. | K+ Na+ Cl-HCO3- | ||
| C. | Cl- NO3- Mg2+ NH4+ | D. | NO3- Na+ Cl-K+ |
 )在碱性条件下水解的装置图。进行皂化反应时的步骤如下:
)在碱性条件下水解的装置图。进行皂化反应时的步骤如下:
 g氢氧化钠,5 mL水和10 mL酒精。加入酒精的作用是____________。
g氢氧化钠,5 mL水和10 mL酒精。加入酒精的作用是____________。 3)图中长玻璃导管的作用为_________________________。
3)图中长玻璃导管的作用为_________________________。