题目内容
【题目】下列叙述正确的是( )
A.水的电离是吸热过程,升高温度,水的离子积增大、pH减小
B.用金属活动性顺序可解释反应:Na(l)+KCl(l)═NaCl(l)+K(g)
C.对于平衡2HI(g)I2(g)+H2(g),压缩容器体积,平衡不移动,气体的颜色不变
D.由反应SiO2+2C ![]() Si+2CO↑,可得出C的非金属性强于Si
Si+2CO↑,可得出C的非金属性强于Si
【答案】A
【解析】解:A.水电离平衡为吸热反应,则升高温度,促进水的电离,氢离子、氢氧根离子浓度均增大,则水的离子积增大、pH减小,故A正确;
B.Na(l)+KCl(l)═NaCl(l)+K(g)中K为气态,逸出后使平衡正向移动,而金属性K大于Na,不能利用金属活动性顺序解释,故B错误;
C.压缩容器体积,浓度增大,气体的颜色加深,但反应为气体体积不变的反应,平衡不移动,故C错误;
D.SiO2+2C ![]() Si+2CO↑为非自发的氧化还原反应,则不能比较C、Si的非金属性,故D错误;
Si+2CO↑为非自发的氧化还原反应,则不能比较C、Si的非金属性,故D错误;
故选A.
【考点精析】解答此题的关键在于理解化学平衡状态本质及特征的相关知识,掌握化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效),以及对弱电解质在水溶液中的电离平衡的理解,了解当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

【题目】甲醇被称为21世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇. ①CH4(g)+H2O(g)CO(g)+3H2(g)△H1
②CO(g)+2H2(g)CH3OH(g)△H2
将0.20mol CH4(g)和0.30mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图.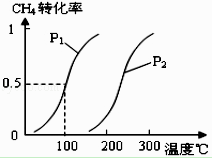
(1)温度不变,缩小体积,增大压强,①的反应速率(填“增大”、“减小”或“不变”),平衡向方向移动.
(2)温度升高,反应①的△H10(填“<”、“=”或“>”),其平衡常数表达式为K= , 100℃时的平衡常数值是 .
(3)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下进行反应②生成甲醇.为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.请在下表空格中填入剩余的实验条件数据.
实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
I | 150 | 1/3 | 0.1 |
II | 5 | ||
III | 350 | 5 |