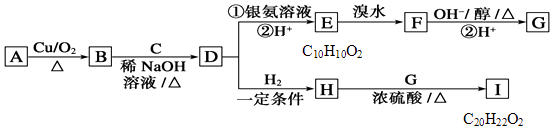
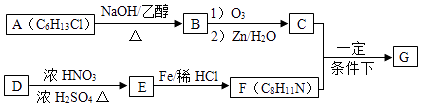
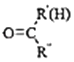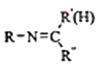题目内容
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,用化学符号填空:
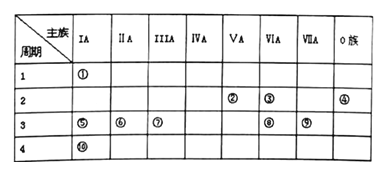
(1)化学性质最不活泼的元素是__________,元素原子半径最小的是____________,⑧号元素的离子结 构示意图为_______________。
(2)在上述元素最高价氧化物对应水化物中,酸性最强的是____________,既能与强酸反应,又能与强碱反应的是___________。写出其与上表元素形成的最强碱反应的化学方程式:____________________。
(3) ⑧、⑨号元素的非金属性较强的是________________。用离子方程式证明其非金属性的强弱________________________________。
【答案】 Ne H ![]() HClO4 Al(OH)3 Al(OH)3+KOH=KAlO2+2H2O Cl S2-+Cl2=S↓+2Cl-或H2S+Cl2=S↓+2Cl-+2H+
HClO4 Al(OH)3 Al(OH)3+KOH=KAlO2+2H2O Cl S2-+Cl2=S↓+2Cl-或H2S+Cl2=S↓+2Cl-+2H+
【解析】根据元素在周期表中的位置知,①~⑩种元素分别是H、N、O、Ne、Na、Mg、Al、S、Cl、K元素,(1)化学性质最不活泼的元素是稀有气体元素,为Ne元素;元素原子半径最小的是H元素;⑧号为S元素,离子结构示意图为![]() ;(2)在上述元素最高价氧化物对应水化物中,酸性最强的是HClO4;既能与强酸反应,又能与强碱反应的是Al(OH)3;上表元素形成的最强碱为KOH,反应的化学方程式为:Al(OH)3+KOH=KAlO2+2H2O;(3) 元素从左到右非金属性增强,故⑧、⑨号元素的非金属性较强的是Cl;用离子方程式证明其非金属性的强弱为S2-+Cl2=S↓+2Cl-或H2S+Cl2=S↓+2Cl-+2H+。
;(2)在上述元素最高价氧化物对应水化物中,酸性最强的是HClO4;既能与强酸反应,又能与强碱反应的是Al(OH)3;上表元素形成的最强碱为KOH,反应的化学方程式为:Al(OH)3+KOH=KAlO2+2H2O;(3) 元素从左到右非金属性增强,故⑧、⑨号元素的非金属性较强的是Cl;用离子方程式证明其非金属性的强弱为S2-+Cl2=S↓+2Cl-或H2S+Cl2=S↓+2Cl-+2H+。

练习册系列答案
相关题目