题目内容
【题目】甲醇被称为21世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇. ①CH4(g)+H2O(g)CO(g)+3H2(g)△H1
②CO(g)+2H2(g)CH3OH(g)△H2
将0.20mol CH4(g)和0.30mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图.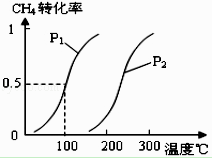
(1)温度不变,缩小体积,增大压强,①的反应速率(填“增大”、“减小”或“不变”),平衡向方向移动.
(2)温度升高,反应①的△H10(填“<”、“=”或“>”),其平衡常数表达式为K= , 100℃时的平衡常数值是 .
(3)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下进行反应②生成甲醇.为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.请在下表空格中填入剩余的实验条件数据.
实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
I | 150 | 1/3 | 0.1 |
II | 5 | ||
III | 350 | 5 |
【答案】
(1)增大;逆反应方向或左
(2)>;![]() ;1.35×10﹣3
;1.35×10﹣3
(3)150;1/3;1/3
【解析】解:(1)CH4(g)+H2O(g)CO(g)+3H2(g)为气体体积增大的反应,增大压强,反应速率增大,平衡逆反应方向或左移动,所以答案是:增大; 逆反应方向或左; (2)由图可知,升高温度,甲烷的转化率增大,即升高温度平衡正向移动,可知△H1>0;K= ![]() ,100℃时的甲烷转化率为0.5,则
,100℃时的甲烷转化率为0.5,则
CH4(g)+ | H2O(g) | CO(g)+ | 3H2(g) | ||
开始 | 0.02 | 0.03 | 0 | 0 | |
转化 | 0.01 | 0.01 | 0.01 | 0.03 | |
平衡 | 0.01 | 0.02 | 0.01 | 0.03 |
K= ![]() =1.35×10﹣3 ,
=1.35×10﹣3 ,
所以答案是:>; ![]() ;1.35×10﹣3;(3)寻找合成甲醇的温度和压强的适宜条件,则实验I和II只有压强不同,II和III只有温度不同,则II中数据分别为150、1/3,III中数据为1/3,所以答案是:
;1.35×10﹣3;(3)寻找合成甲醇的温度和压强的适宜条件,则实验I和II只有压强不同,II和III只有温度不同,则II中数据分别为150、1/3,III中数据为1/3,所以答案是:
实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
I | |||
II | 150 | 1/3 | |
III | 1/3 |
【考点精析】掌握化学平衡的计算是解答本题的根本,需要知道反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案【题目】人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].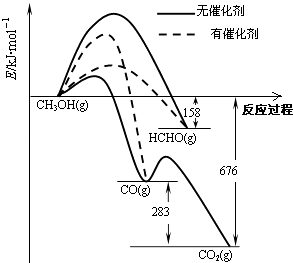
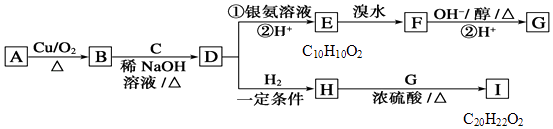
(1)①在有催化剂作用下,CH3OH与O2反应主要生成(填“CO、CO2”或“HCHO”).2HCHO(g)+O2(g)═2CO(g)+2H2O(g)△H= .
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性.用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: .
(2)已知:CO(g)+2H2(g)CH3OH(g)△H=﹣a kJmol﹣1 .
①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4molL﹣1、c(H2)=0.4molL﹣1、c(CH3OH)=0.8molL﹣1 , 则此时v正v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15min,用H2表示的平均反应速率为 , 达到平衡时CO的转化率为 .
(3)利用钠碱循环法可除去SO2 , 消除SO2对环境的污染.吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①根据上表判断NaHSO3溶液显性.
②在NaHSO3溶液中离子浓度关系正确的是 (填字母).
a.c(Na+)=2c(SO32﹣)+c(HSO3﹣)
b.c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣)
c.c(H2SO3)+c(H+)=c(SO32﹣)+(OH﹣)
d.c(Na+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)