题目内容
【题目】观察下图A、B、C三个装置,回答下列问题:
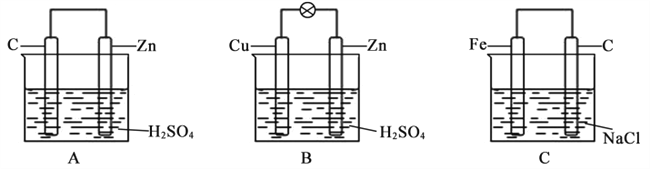
(1)把一块纯净的锌片插入装有稀硫酸的烧杯中,可观察到锌片上有气泡,再平行插入一碳棒,可观察到碳棒上______(填“有”或“没有”)气泡产生。用导线把锌片和碳棒连接起来组成一个原电池(图A),正极的反应式为______________。
(2)如果烧杯中最初装入的是500 mL2 mol/L硫酸溶液,构成铜锌原电池(图B,假设产生的气体没有损失),当收集到11.2 L(标准状况下)H2时,溶液体积变化忽略不计,则烧杯内溶液中溶质及其物质的量浓度为________。
(3)如果电极材料分别是铁片和石墨并进行连接,插入氯化钠溶液中(图C),放置数天后,铁片生锈。负极反应式为___________。
(4)将铜粉末用10% H2O2和3.0 mol/L的H2SO4混合溶液处埋,测得不同温度下铜的平均溶解速率如下表:
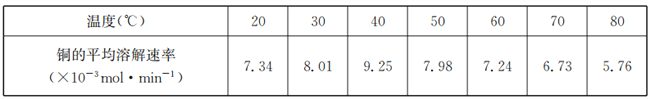
由表中数据可知,当温度高于40℃时,铜的平均溶解速率随着温度的升高而下降,其主要原因是________________。
【答案】 没有 2H++2e-=H2↑ c(H2SO4)=1mol/L c(ZnSO4)=1mol/L Fe-2e-=Fe2+ 温度越高,H2O2越容易分解(或其他合理答案)
【解析】(1)把一块纯净的锌片插入装有稀硫酸的烧杯中,锌与稀硫酸反应生成氢气,可观察到锌片上有气泡,再平行插入一碳棒,碳与稀硫酸不反应,因此碳棒上没有气泡产生;锌片、碳棒和硫酸形成的原电池中,碳棒为正极,该极上氢离子得电子生成氢气,电极反应为: 2H++2e-=H2↑;正确答案:没有;2H++2e-=H2↑。
(2) 根据正极反应: 2H++2e-=H2↑,当在标准状况下收集到11.2L即0.5mol的氢气时,转移电子是1mol,减少的氢离子为1mol,所以剩余的硫酸的量为0.5 mol,其浓度为0.5/0.5=1mol/L;负极上的电极反应式为:Zn-2e-=Zn,当转移电子1mol时,生成锌离子的量为0.5mol,所以c(ZnSO4)=0.5/0.5=1mol/L ;正确答案:c(H2SO4)=1mol/L;c(ZnSO4)=1mol/L。
(3) 铁片、石墨和氯化钠溶液构成的原电池中,金属铁发生吸氧腐蚀,正极上是氧气得电子发生还原反应,负极是铁失电子变为亚铁离子,发生氧化反应,电极反应为:Fe-2e-=Fe2+;正确答案:Fe-2e-=Fe2+。
(4)双氧水具有强氧化性和不稳定性,温度太高,双氧水易发生分解,氧化能力降低,铜的平均溶解速率随着温度的升高而下降,因此要控制反应的温度不能过高;正确答案:温度越高,H2O2越容易分解(或其他合理答案)。

 备战中考寒假系列答案
备战中考寒假系列答案