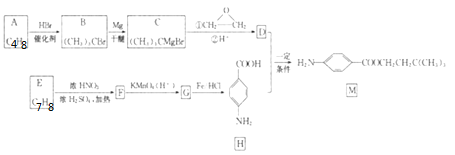
题目内容
【题目】K2S2O8具有强氧化性(S2O82-中含有过氧根),在石油行业中有重要用途,工业上可利用电解法制备它,工作原理如图(电极材料是石墨)所示,下列说法中错误的是
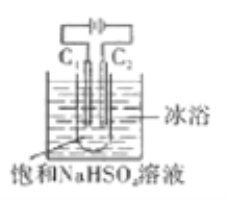
A. C1电极上的电极反应式为:2SO42--2e-=S2O82-
B. 通电后Na+移向C2电极
C. 反应一段时间后,溶液的pH减小
D. 电解过程中,两电极上参与反应的离子的物质的量相等
【答案】C
【解析】根据装置图,C1与直流电源的正极相连,C1为阳极,C2与直流电源的负极相连,C2为阴极。A项,S2O82-中S元素的化合价为+7价,C1为阳极,C1电极上的电极反应式为2SO42--2e-=S2O82-,A项正确;B项,C2为阴极,通电后阳离子向阴极移动,通电后Na+移向C2电极,B项正确;C项,Na+的放电能力小于H+,C2电极上的电极反应式为2H++2e-=H2↑,电解总离子方程式为2SO42-+2H+![]() S2O82-+H2↑,反应一段时间后c(H+)减小,溶液的pH增大,C项错误;D项,根据阴、阳极上得失电子守恒和电极反应式,电解过程中,两电极上参与反应的离子物质的量相等,D项正确;答案选C。
S2O82-+H2↑,反应一段时间后c(H+)减小,溶液的pH增大,C项错误;D项,根据阴、阳极上得失电子守恒和电极反应式,电解过程中,两电极上参与反应的离子物质的量相等,D项正确;答案选C。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目