题目内容
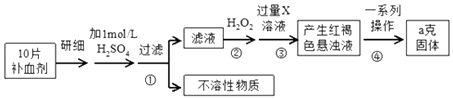
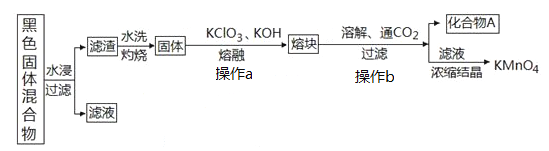
【题目】下图表示从废旧普通锌锰电池内容物中回收制备KMnO4等物质的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
(1)KMnO4稀溶液是一种常用消毒剂,其消毒机理与下列物质相似的是______________(填序号)
A.双氧水 B.75%酒精 C.苯酚 D.84消毒液(NaClO溶液)
(2)①黑色固体混合物水浸时为提高浸出速率,常采用的措施为_________________(答出两条即可)。
②滤渣水洗灼烧后固体是一种黑色的化合物,操作a中得到熔块的主要成分是K2MnO4和KCl,该过程中发生反应的化学方程式为:_____________________________。
③图中产物A是一种难溶于水的黑色固体,其化学式为:_________________。
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250mL0.1000mol·L-1标准Na2S2O3溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒和______、_______;
②取上述制得的KMnO4产品0.7000g,酸化后用0.1000mol·L-1标准Na2S2O3溶液进行滴定,滴定至终点记录实验消耗Na2S2O3溶液的体积,重复步骤②,三次平行实验数据如下表。
实验次数 | 1 | 2 | 3 |
消耗Na2S2O3溶液体积/mL | 19.30 | 20.98 | 21.02 |
(有关离子方程式为:MnO4-+S2O32-+H+—SO42-+Mn2++H2O,未配平)
将0.1000mol·L-1标准Na2S2O3溶液盛装在________(填“酸式”或“碱式”)滴定管中进行滴定。计算该KMnO4产品的纯度_________________。
【答案】 AD 加热、将固体混合物粉碎、搅拌 3MnO2 + KClO3 + 6KOH ![]() 3K2MnO4 +KCl+3H2O MnO2 玻璃棒 250mL容量瓶 碱式 75.84%
3K2MnO4 +KCl+3H2O MnO2 玻璃棒 250mL容量瓶 碱式 75.84%
【解析】试题分析:本题是以从废旧普通锌锰电池内容物中回收制备KMnO4为载体,考查考生对KMnO4的强氧化性、化学反应速率(此题为固体溶解速率)的影响因素、氧化还原反应方程式配平和书写、滴定以及滴定计算等知识掌握程度,考查考生对实验流程的分析能力和对知识的综合应用能力。
解析:普通锌锰电池中存在MnO2、石墨,由于其不溶于水,而电池中其余为可溶物,所以水浸、过滤后滤渣是MnO2和C(不考虑废旧电池中实际存在的少量其他金属),水洗除去固体表面残留溶质,灼烧去除C,剩余固体只有MnO2。MnO2固体与KClO3、KOH高温熔融时发生氧化还原反应,向下的问题中提示生成K2MnO4和KCl。再将熔块溶解并通入CO2、分离得到KMnO4,因此操作b中发生反应生成KMnO4,同时得到的黑色固体((3)③中描述)是MnO2。(1)KMnO4的消毒作用是利用了KMnO4的强氧化性杀灭病菌,与选项中AD相似,B选项75%酒精的消毒原理是利用酒精使病毒蛋白质发生变性,C选项苯酚则是利用苯酚的毒性杀灭病毒,则二者消毒的原理均与KMnO4不同,正确答案AD。(2)①水浸是使废电池中的可溶物充分溶解,单位时间提高浸出率就是提高溶解速率,所以可以采用加热、搅拌、粉碎固体使其颗粒更小等措施加速固体的溶解,正确答案:加热、将固体混合物粉碎、搅拌(选其二)。②结合上述解析,该反应基本物质关系为KClO3+MnO2+KOH→K2MnO4+KCl,配平之后即可得到答案,正确答案:3MnO2+KClO3+6KOH ![]() 3K2MnO4+KCl+3H2O。③答案:MnO2。(3)①配制溶液时缺少玻璃棒和250mL容量瓶。②Na2S2O3溶液由于S2O32-水解呈碱性,所以应当放在碱式滴定管中。从滴定消耗Na2S2O3体积看,第一次实验明显存在较大误差,应当舍去,滴定过程中发生反应有关离子方程式为:8MnO4-+5S2O32-+14H+=10SO42-+8Mn2++7H2O,n(KMnO4)=8/5×0.1000mol/L×
3K2MnO4+KCl+3H2O。③答案:MnO2。(3)①配制溶液时缺少玻璃棒和250mL容量瓶。②Na2S2O3溶液由于S2O32-水解呈碱性,所以应当放在碱式滴定管中。从滴定消耗Na2S2O3体积看,第一次实验明显存在较大误差,应当舍去,滴定过程中发生反应有关离子方程式为:8MnO4-+5S2O32-+14H+=10SO42-+8Mn2++7H2O,n(KMnO4)=8/5×0.1000mol/L×![]() ×10-3L=3.36×10-3mol ,KMnO4纯度=3.36×10-3mol×158g·mol-1/0.7000g=0.7584=75.84%。正确答案:碱式 75.84%。
×10-3L=3.36×10-3mol ,KMnO4纯度=3.36×10-3mol×158g·mol-1/0.7000g=0.7584=75.84%。正确答案:碱式 75.84%。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案【题目】在2L密闭容器内,800℃时反应:2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)NO的平衡浓度c(NO)= .
(2)用O2表示从0﹣2s内该反应的平均反应速率v= .
(3)如图中表示NO2变化的曲线是 . 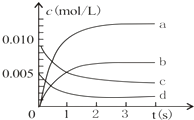
(4)能说明该反应已达到平衡状态的是 . a.v(NO2)=2v(O2)
b.容器内气体总物质的量保持不变
c.V逆(NO)=2v正(O2)
d.容器内气体的密度保持不变.