题目内容
【题目】对于化学反应中的能量变化,表述正确的是( )
A.中和反应是吸热反应
B.燃烧属于放热反应
C.断开化学键的过程会放出能量
D.加热才能发生的反应一定是吸热反应
【答案】B
【解析】解:A、中和反应属于常见的放热反应,故A错误;B、燃烧反应放出热量,属于放热反应,故B正确;
C、断开旧的化学键的过程会吸收能量,故C错误;
D、需要加热才能进行的反应,不一定是吸热反应,如2Al+Fe2O3 ![]() Al2O3+2Fe是放热反应,但需在加热条件下以保证足够的热量引发氧化铁和铝粉反应,故D错误.
Al2O3+2Fe是放热反应,但需在加热条件下以保证足够的热量引发氧化铁和铝粉反应,故D错误.
故选B.
【考点精析】认真审题,首先需要了解吸热反应和放热反应(化学上把吸收热量的化学反应称为吸热反应;化学上把放出热量的化学反应称为放热反应).

【题目】下图表示从废旧普通锌锰电池内容物中回收制备KMnO4等物质的一种工艺(不考虑废旧电池中实际存在的少量其他金属)。
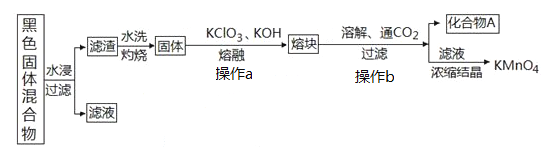
(1)KMnO4稀溶液是一种常用消毒剂,其消毒机理与下列物质相似的是______________(填序号)
A.双氧水 B.75%酒精 C.苯酚 D.84消毒液(NaClO溶液)
(2)①黑色固体混合物水浸时为提高浸出速率,常采用的措施为_________________(答出两条即可)。
②滤渣水洗灼烧后固体是一种黑色的化合物,操作a中得到熔块的主要成分是K2MnO4和KCl,该过程中发生反应的化学方程式为:_____________________________。
③图中产物A是一种难溶于水的黑色固体,其化学式为:_________________。
(3)测定KMnO4产品的纯度可用标准Na2S2O3溶液进行滴定。
①配制250mL0.1000mol·L-1标准Na2S2O3溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒和______、_______;
②取上述制得的KMnO4产品0.7000g,酸化后用0.1000mol·L-1标准Na2S2O3溶液进行滴定,滴定至终点记录实验消耗Na2S2O3溶液的体积,重复步骤②,三次平行实验数据如下表。
实验次数 | 1 | 2 | 3 |
消耗Na2S2O3溶液体积/mL | 19.30 | 20.98 | 21.02 |
(有关离子方程式为:MnO4-+S2O32-+H+—SO42-+Mn2++H2O,未配平)
将0.1000mol·L-1标准Na2S2O3溶液盛装在________(填“酸式”或“碱式”)滴定管中进行滴定。计算该KMnO4产品的纯度_________________。
