题目内容
10.在密闭容器中,将2.0molCO和10molH2O(g)混合加热到800℃,达到平衡(K=1.0):CO(g)+H2O(g)?CO2(g)+H2(g),则CO转化为CO2的转化率为( )| A. | 33.3% | B. | 83% | C. | 66.7% | D. | 50% |
分析 在密闭容器中,将2.0molCO和10molH2O(g)混合加热到800℃,设平衡时转化的CO为xmol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):2 10 0 0
转化量(mol):x x x x
平衡量(mol):2-x 10-x x x
由于反应气体气体的物质的量不变,用物质的量代替浓度代入K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=1列方程计算解答.
解答 解:在密闭容器中,将2.0molCO和10molH2O(g)混合加热到800℃,设平衡时转化的CO为xmol,则:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol):2 10 0 0
转化量(mol):x x x x
平衡量(mol):2-x 10-x x x
由于反应气体气体的物质的量不变,可以用物质的量代替浓度计算平衡常数,则K=$\frac{c(C{O}_{2})×c({H}_{2})}{c(CO)×c({H}_{2}O)}$=$\frac{x×x}{(2-x)×(10-x)}$=1,解得x=$\frac{5}{3}$,
故CO的转化率为$\frac{\frac{5}{3}mol}{2mol}$×100%≈83%,
故选:B.
点评 本题考查化学平衡计算,涉及平衡常数应用,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
20.设NA代表阿伏加德罗常数,下列说法正确的是( )
| A. | 5.6 g铁与足量盐酸反应转移的电子数为0.3 NA | |
| B. | 100 mL 2.0 mol/L的盐酸与醋酸溶液中氢离子均为0.2 NA | |
| C. | 标准状况下,22.4 L氦气与22.4 L氯气所含原子数均为2 NA | |
| D. | 16 g氧气和16 g臭氧所含的原子数均为NA |
1.一定温度下,在2L的密闭容器中充入2molN2和2molH2,进行反应:N2(g)+3H2(g)═2NH3(g)△H<0.经2分钟到达平衡,此时NH3为0.4mol•L-1.则下列说法正确的是( )
| A. | 到达平衡用NH3的平均速率为0.2mol•L-1•min-1 | |
| B. | 升高温度平衡会逆向移动,当密度不再变化时该反应又再次到达平衡 | |
| C. | 平衡时H2的转化率为60% | |
| D. | 在其它条件不变,将体积压缩到1L后再平衡时,c(H2)=0.2mol•L-1 |
18.下列热化学方程式正确的是(注:△H的绝对值均正确)( )
| A. | S(s)+O2(g)=SO2(g);△H=-269.8kJ/mol(反应热) | |
| B. | 2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l);△H=-114.6kJ/mol(中和热) | |
| C. | 2NO2=O2+2NO;△H=+116.2kJ/mol(反应热) | |
| D. | C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) |
15.历史上曾用“灼烧辰砂法”制取汞,目前工业上制粗汞的一种流程图如图.

下列分析错误的是( )

下列分析错误的是( )
| A. | “灼烧辰砂法”过程中电子转移的方向和数目可表示为: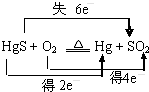 | |
| B. | 辰砂与氧化钙加热反应时,CaSO4为还原产物 | |
| C. | 洗涤粗汞可用5%的盐酸代替5%的硝酸 | |
| D. | 减压蒸馏的目的是降低汞的沸点,提高分离效率 |
2.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害.在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)?COS(g)+H2(g) K=0.1.反应前CO的物质的量为10mol,平衡后CO物质的量为8mol,下列说法正确的是( )
| A. | 建立平衡过程中,CO减少的浓度大于H2S减少的浓度 | |
| B. | 通入CO后重新达平衡,正、逆反应速率均增大 | |
| C. | 反应前H2S物质的量为7mol | |
| D. | CO的平衡转化率为80% |