题目内容
15.历史上曾用“灼烧辰砂法”制取汞,目前工业上制粗汞的一种流程图如图.
下列分析错误的是( )
| A. | “灼烧辰砂法”过程中电子转移的方向和数目可表示为: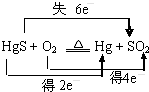 | |
| B. | 辰砂与氧化钙加热反应时,CaSO4为还原产物 | |
| C. | 洗涤粗汞可用5%的盐酸代替5%的硝酸 | |
| D. | 减压蒸馏的目的是降低汞的沸点,提高分离效率 |
分析 A.该反应中S元素化合价由-2价变为+4价、Hg元素化合价由+2价变为0价、O元素化合价由0价变为-2价,转移电子数为6;
B.化合价升高的元素所在的产物是氧化产物;
C.金属铜可以和硝酸之间反应,但是和盐酸之间不反应;
D.实验目的是获得纯汞,利用汞的熔沸点温度确定分离方法.
解答 解:A.化学反应中化合价的升高的元素是S,降低的元素是Hg和O,化合价升高数=化合价降低数值=转移电子数,故A正确;
B.辰砂与氧化钙加热反应时,化合价升高的元素是S,所以CaSO4是氧化产物,故B错误;
C.粗汞中含有的金属铜可以和硝酸之间反应,但是和盐酸之间不反应,所以洗涤粗汞不可用5%的盐酸代替5%的硝酸,故C错误;
D.实验目的是获得纯汞,最后一步根据汞(熔点-39℃,沸点356℃)可以减压蒸馏降低汞的沸点,提高分离效率,故D正确;
故选BC.
点评 本题以金属冶炼为载体考查氧化还原反应,为高频考点,侧重考查基本理论、基本原理,明确反应原理及物质性质是解本题关键,易错选项是CD.

练习册系列答案
相关题目
6.分别将2mol的N2和3molH2的混合气体,在一定条件下发生反应.达到平衡时,容器内压强为反应开始时的$\frac{4}{5}$,则N2的转化率为( )
| A. | 50% | B. | 37.5% | C. | 25% | D. | 75% |
10.在密闭容器中,将2.0molCO和10molH2O(g)混合加热到800℃,达到平衡(K=1.0):CO(g)+H2O(g)?CO2(g)+H2(g),则CO转化为CO2的转化率为( )
| A. | 33.3% | B. | 83% | C. | 66.7% | D. | 50% |
7.NA表示阿伏加德罗常数,下列判断错误的是( )
| A. | 常温下,22 gCO2 中含有NA个氧原子 | |
| B. | 1mol/L CaCl2溶液中Cl-的数目等于2NA | |
| C. | 标准状况下,33.6LCH4中含H原子数为6NA | |
| D. | 1ol Na 完全反应时,失去NA个电子 |
4.在容积可变的密闭容器中,充入适量X与Y的混合气,一定条件下发生反应:X(气)+3Y(气)?2Z(气)若维持温度与压强不变,达平衡时,容器容积为VL,其中Z占10%,下列推断中,正确的是( )
| A. | 原X、Y混合气体积为1.2VL | B. | 原X、Y混合气体积为1.1VL | ||
| C. | 达平衡时,消耗X体积为0.25VL | D. | 达平衡时,消耗Y体积为0.05VL |
5.下列叙述正确的是( )
| A. | 同温同压下,1L一氧化碳气体一定比1L氧气的质量小 | |
| B. | 任何条件下,等物质的量的甲烷(CH4)和一氧化碳所含的原子数一定相等 | |
| C. | 同温同压下的二氧化碳气体和氮气,若体积相等,则质量一定相等 | |
| D. | 同温同压下,相同体积的气体,其分子数一定相等,原子数也一定相等 |
