题目内容
18.下列热化学方程式正确的是(注:△H的绝对值均正确)( )| A. | S(s)+O2(g)=SO2(g);△H=-269.8kJ/mol(反应热) | |
| B. | 2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l);△H=-114.6kJ/mol(中和热) | |
| C. | 2NO2=O2+2NO;△H=+116.2kJ/mol(反应热) | |
| D. | C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g);△H=-1367.0 kJ/mol(燃烧热) |
分析 A、热化学方程式是标注物质聚集状态,反应放出的热量;
B、中和热是强酸强碱的稀溶液完全反应生成1mol水放出的热量;
C、热化学方程式要标明物质的聚集状态;
D、燃烧热是1mol可燃物完全燃烧生成稳定氧化物时放出的热量;
解答 解:A、S(s)+O2(g)=SO2(g)△H=-269.8kJ/mol(反应热),符合热化学方程式的书写,故A正确;
B、2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l);△H=-114.6kJ/mol((中和热),这里的硫酸是稀硫酸才是合理的,故B错误;
C、热化学方程没有标明物质的聚集状态,故C错误;
D、C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(g)△H=-1367.0 kJ/mol(燃烧热)反应中生成的氧化物水是气体,不是稳定氧化物,故D错误.
故选A.
点评 本题考查了燃烧热、中和热、热化学方程式的书写方法和判断,关键是概念的理解,题目较简单.

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
8.在[Pb2+]为0.200mol/L的溶液中,若每升加入0.201mol的Na2SO4(设条件不变),留在溶液中的Pb2+的百分率是(已知PbSO4的Ksp=1.8×10-8)( )
| A. | 1×10-3% | B. | 2×10-4% | C. | 9×10-3% | D. | 2.5×10-20% |
9.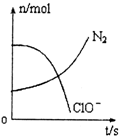 容器中发生一化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
容器中发生一化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
 容器中发生一化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
容器中发生一化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质,在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 还原剂是含CN-的物质,氧化产物只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 氧化剂与还原剂的化学计量数之比为5:2 | |
| D. | 若生成2.24LN2,则转移电子必定为1mol |
6.分别将2mol的N2和3molH2的混合气体,在一定条件下发生反应.达到平衡时,容器内压强为反应开始时的$\frac{4}{5}$,则N2的转化率为( )
| A. | 50% | B. | 37.5% | C. | 25% | D. | 75% |
10.在密闭容器中,将2.0molCO和10molH2O(g)混合加热到800℃,达到平衡(K=1.0):CO(g)+H2O(g)?CO2(g)+H2(g),则CO转化为CO2的转化率为( )
| A. | 33.3% | B. | 83% | C. | 66.7% | D. | 50% |
7.NA表示阿伏加德罗常数,下列判断错误的是( )
| A. | 常温下,22 gCO2 中含有NA个氧原子 | |
| B. | 1mol/L CaCl2溶液中Cl-的数目等于2NA | |
| C. | 标准状况下,33.6LCH4中含H原子数为6NA | |
| D. | 1ol Na 完全反应时,失去NA个电子 |
8.当光束通过下列分散系时,能观察到丁达尔效应的是( )
| A. | 淀粉溶液 | B. | 泥水 | C. | NaCl 溶液 | D. | 浓盐酸 |
