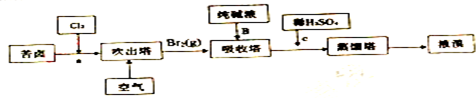
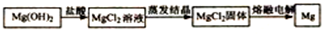题目内容
11.下列叙述中正确的是( )| A. | Ca(ClO)2溶液:c(Ca2+)>c(ClO-)>c(OH-)>c(H+) | |
| B. | 等体积、等物质的量浓度的NaX和弱酸HX混合,溶液呈酸性:c(HX)>c(X-) | |
| C. | 中和pH与体积都相同的盐酸和硫酸,消耗NaOH的物质的量之比是1:2 | |
| D. | 25℃时,若10mLpH=a的盐酸与100mLpH=b的Ba(OH)2溶液混合后恰好完全反应,则a+b=13 |
分析 A.次氯酸根离子的水解程度较小,则c(ClO-)>c(Ca2+);
B.混合液呈酸性,则HX的电离程度大于X-的水解程度,则c(HX)<c(X-);
C.pH相等的盐酸和硫酸中氢离子浓度相等,则消耗氢氧化钠的物质的量相等;
D.混合液恰好反应,则氢离子与氢氧根离子的物质的量相等,据此进行计算.
解答 解:A.次氯酸钙溶液中,次氯酸根离子部分水解,溶液呈碱性,则c(OH-)>c(H+),由于次氯酸根离子的水解程度较小,则c(ClO-)>c(Ca2+),所以溶液中正确的离子浓度大小为:c(ClO-)>c(Ca2+)>c(OH-)>c(H+),故A错误;
B.等体积、等物质的量浓度的NaX和弱酸HX混合,溶液呈酸性,说明HX的电离程度大于X-的水解程度,则:c(HX)<c(X-),故B错误;
C.中和pH与体积都相同的盐酸和硫酸,由于氯化氢和硫酸都是强电解质,则两溶液中氢离子浓度相等,所以消耗NaOH的物质的量之比是1:1,故C错误;
D.25℃时,若10mLpH=a的盐酸中氢离子的浓度为:10-amol/L,100mLpH=b的Ba(OH)2溶液中氢氧根离子浓度为:10b-14mol/L,两溶液混合后恰好完全反应,则:10-amol/L×0.01L=10b-14mol/L×0.1L,整理可得:a+b=13,故D正确;
故选D.
点评 本题考查了离子浓度大小比较、酸碱混合的定性判断及溶液pH的计算,题目难度中等,注意掌握酸碱混合的定性判断方法及溶液pH的计算方法,明确盐的水解原理、电荷守恒等知识在比较离子浓度大小中的应用方法.

练习册系列答案
 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案
相关题目
1.关于如图所示装置的叙述.正确的是( )
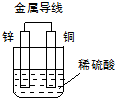

| A. | 铜是阳极,铜片上有气泡产生 | B. | 铜片质量逐渐减少 | ||
| C. | 电子从锌片经导线流向铜片 | D. | 氢离子在铜片表面被氧化 |
2.下列分子结构中,原子的最外层电子满足8电子稳定结构的是( )
| A. | SO3 | B. | PF5 | C. | CCl4 | D. | NO2 |
19.从化学视角认识生产生活中的一些现象,其中错误的是( )
| A. | 打开汽水瓶盖时有大量气泡冒出,可用勒夏特列原理解释 | |
| B. | 用热的纯碱(Na2CO3)溶液容易洗去餐具上的油污 | |
| C. | 向牛奶中加入果汁会产生沉淀,这是因为酸碱发生了中和反应 | |
| D. | 用铁制自来水管与铜制水龙头连接使用时,连接处的铁水管锈蚀更快 |
6.某有机物溶解于NaOH溶液中(滴有酚酞试液的),开始溶液呈红色,煮沸几分钟后,溶液褪色,加入盐酸至酸性时,析出白色的晶体,该晶体溶于水,加入FeCl3溶液呈紫色,该有机物可能是( )
| A. | 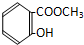 | B. | 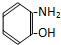 | C. | 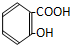 | D. | 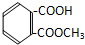 |
16.a、b、c三种元素,a、b同周期,a、c同主族,它们原子的最外层电子数之和为16,则这三种元素可能是
( )
( )
| A. | P、S、N | B. | Cl、S、F | C. | S、Cl、O | D. | K、Ca、Na |
3.Se是人体必需微量元素,下列关于${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se的说法正确的是( )
| A. | H278Se的稳定性比H2S稳定性强 | |
| B. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同素异形体 | |
| C. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se组成的气态物质属于化合物 | |
| D. | ${\;}_{34}^{78}$Se和${\;}_{34}^{80}$Se互为同位素,分别含有44和46个中子 |
20.某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气.所用燃料为氢气,电解质为熔融的碳酸钾.已知该电池的总反应为2H2+O2═2H2O,正极反应为O2+2CO2+4e-═2CO3-,则下列推断正确的是( )
| A. | 负极反应为H2+2OH--2e-═2H2O | |
| B. | 放电时负极有CO2生成 | |
| C. | 该电池供应2 mol水蒸气,同时转移2 mol电子 | |
| D. | 该电池可在常温或高温时进行工作,对环境具有较强的适应性 |