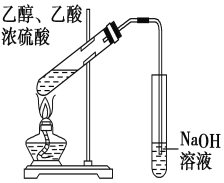
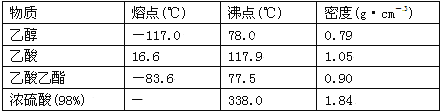
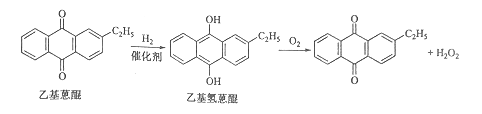
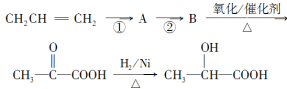题目内容
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+与Al3+的化学性质相似。在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42和Cr2O72在溶液中可相互转化。室温下,初始浓度为1.0 mol![]() L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。
L1的Na2CrO4溶液中c(Cr2O72)随c(H+)的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性增大,CrO42的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH______0(填“大于”“小于”或“等于”)。
(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl,利用Ag+与CrO42生成砖红色沉淀,指示到达滴定终点。当溶液中Cl恰好沉淀完全(浓度等于1.0×105 mol·L1)时,溶液中c(Ag+)为_______ mol![]() L1,此时溶液中c(CrO42)等于__________ mol
L1,此时溶液中c(CrO42)等于__________ mol![]() L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
L1。(已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
(4)+6价铬的化合物毒性较大,常用NaHSO3将废液中的Cr2O72还原成Cr3+,该反应的离子方程式为______________。
【答案】(1)蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液;
(2)①2CrO42-+2H+![]() Cr2O72-+H2O; ② 增大;1.0×1014 ;③小于;
Cr2O72-+H2O; ② 增大;1.0×1014 ;③小于;
(3)2.0×10-5 ;5×10-3;(4)Cr2O72+3HSO3 +5H+=2Cr3++3SO42+4H2O。
【解析】
试题分析:(1)根据Cr3+与Al3+的化学性质相似,可知Cr(OH)3是两性氢氧化物,能溶解在强碱NaOH溶液中。向Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,首先发生反应:Cr3++3OH-=Cr(OH)3↓,产生Cr(OH)3灰蓝色固体,当碱过量时,又会发生反应:Cr(OH)3+OH-= Cr(OH)4,可观察到沉淀消失,溶液变为绿色。故观察到的现象为蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液;(2)①随着H+浓度的增大,CrO42-与溶液中的H+发生反应,反应转化为Cr2O72-的离子反应式为:2CrO42-+2H+![]() Cr2O72-+H2O。②根据化学平衡移动原理,溶液酸性增大,c(H+)增大,化学平衡2CrO42-+2H+
Cr2O72-+H2O。②根据化学平衡移动原理,溶液酸性增大,c(H+)增大,化学平衡2CrO42-+2H+![]() Cr2O72-+H2O向正反应方向进行,导致CrO42的平衡转化率增大;根据图像可知,在A点时,c(Cr2O72-)=0.25 mol/L,由于开始时c(CrO42)=1.0 mol/L,根据Cr元素守恒可知A点的溶液中CrO42-的浓度c(CrO42)=0.5 mol/L;H+浓度为1.0×10-7 mol/L;此时该转化反应的平衡常数为
Cr2O72-+H2O向正反应方向进行,导致CrO42的平衡转化率增大;根据图像可知,在A点时,c(Cr2O72-)=0.25 mol/L,由于开始时c(CrO42)=1.0 mol/L,根据Cr元素守恒可知A点的溶液中CrO42-的浓度c(CrO42)=0.5 mol/L;H+浓度为1.0×10-7 mol/L;此时该转化反应的平衡常数为![]() ;③由于升高温度,溶液中CrO42的平衡转化率减小,说明升高温度,化学平衡逆向移动,导致溶液中CrO42的平衡转化率减小,根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应,故该反应的ΔH<0;(3)当溶液中Cl完全沉淀时,即c(Cl-)=1.0×105 mol·L1,根据溶度积常数Ksp(AgCl)=2.0×1010,可得溶液中c(Ag+)=Ksp(AgCl)÷c(Cl-)=2.0×1010÷(1.0×105 mol·L1)=2.0×10-5 mol·L1;则此时溶液中c(CrO42)=Ksp(Ag2CrO4)/c2(Ag+)=2.0×1012÷(2.0×10-5 mol·L1)=5×10-3mol·L1;(4) NaHSO3具有还原性,Cr2O72具有氧化性,二者会发生氧化还原反应,根据已知条件,结合电子守恒、电荷守恒、原子守恒,可得二者反应的离子方程式为:Cr2O72+3HSO3 +5H+=2Cr3++3SO42+4H2O。
;③由于升高温度,溶液中CrO42的平衡转化率减小,说明升高温度,化学平衡逆向移动,导致溶液中CrO42的平衡转化率减小,根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动,逆反应方向是吸热反应,所以该反应的正反应是放热反应,故该反应的ΔH<0;(3)当溶液中Cl完全沉淀时,即c(Cl-)=1.0×105 mol·L1,根据溶度积常数Ksp(AgCl)=2.0×1010,可得溶液中c(Ag+)=Ksp(AgCl)÷c(Cl-)=2.0×1010÷(1.0×105 mol·L1)=2.0×10-5 mol·L1;则此时溶液中c(CrO42)=Ksp(Ag2CrO4)/c2(Ag+)=2.0×1012÷(2.0×10-5 mol·L1)=5×10-3mol·L1;(4) NaHSO3具有还原性,Cr2O72具有氧化性,二者会发生氧化还原反应,根据已知条件,结合电子守恒、电荷守恒、原子守恒,可得二者反应的离子方程式为:Cr2O72+3HSO3 +5H+=2Cr3++3SO42+4H2O。

 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案