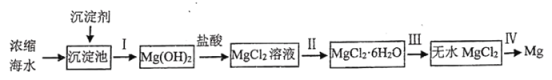
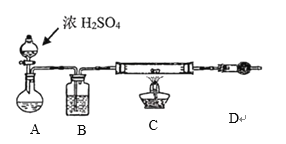
题目内容
【题目】将物质的量之比为1:1的Fe、Cu的混合粉末逐渐加入到含1mol![]() 的稀硝酸中充分反应(还原产物全部是NO),则能使硝酸完全反应的金属粉末的最小质量为
的稀硝酸中充分反应(还原产物全部是NO),则能使硝酸完全反应的金属粉末的最小质量为
A.14gB.15gC.18gD.22.5g
【答案】C
【解析】
Cu和铁1:1与硝酸发生反应,硝酸不仅起着氧化剂的作用,还起着酸的作用,且酸消耗的的量较大,由反应配平后的离子反应方程式可以得到H+与金属之间的关系,从而得到金属的质量(金属的最小质量值得就是将硝酸消耗完时候金属恰好完全反应)。根据铁、铜分别于硝酸反应的离子方程式为:3Cu+8H++ 2NO3-=3Cu2+ +2NO↑+4H2O 、Fe+4H+ +NO3-==Fe3+ +2H2O+NO↑ ,两式合并得:3Cu+3Fe+20H++5NO3-=3Cu2+ +3Fe3+ +5NO↑+10H2O;
H+~3/20 Cu~3/20 Fe
1mol 3/20mol 3/20mol
所以金属最小的质量为3/20×(64g/mol+56g/mol)=18g
答案为C。

【题目】下列实验操作能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 检验KIO3中的碘元素 | 取少量KIO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液 |
B | 检验石油裂解气中的乙烯 | 将混合气体通入足量酸性KMnO4溶液中 |
C | 比较HClO和CH3COOH的酸性强弱 | 室温下,用pH计测定饱和的NaClO溶液和饱和的 |
D | 硅酸胶体的制备 | 向 |
A.AB.BC.CD.D
【题目】根据杂化轨道理论和价电子对互斥模型判断,下列分子或者离子的中心原子杂化方式及空间构型正确的是( )
选项 | 分子或离子 | 中心原子杂化方式 | 价电子对互斥模型 | 分子或离子的立体构型 |
A. | SO2 | sp | 直线形 | 直线形 |
B. | HCHO | sp2 | 平面三角形 | 三角锥形 |
C. | NF3 | sp2 | 四面体形 | 平面三角形 |
D. |
| sp3 | 正四面体形 | 正四面体形 |
A. AB. BC. CD. D