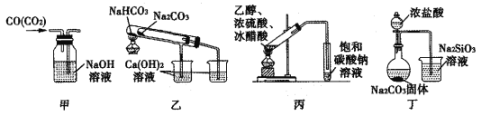
题目内容
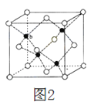
【题目】有关晶体的结构如下图所示,下列说法中不正确的是
A. 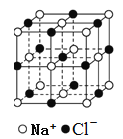 在NaCl晶体中,距Na+最近的Cl-形成正八面体
在NaCl晶体中,距Na+最近的Cl-形成正八面体
B. 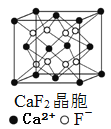 在CaF2晶体中,每个晶胞平均占有4个Ca2+
在CaF2晶体中,每个晶胞平均占有4个Ca2+
C.  在石墨晶体中,每个环上平均占有3个碳原子
在石墨晶体中,每个环上平均占有3个碳原子
D. 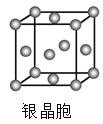 在银晶体中,银原子的配位数为12
在银晶体中,银原子的配位数为12
【答案】C
【解析】
A.氯化钠晶体中,距Na+最近的Cl-是6个,即钠离子的配位数是6,6个氯离子形成正八面体结构,故A正确;
B.Ca2+位于晶胞顶点和面心,数目为8×1/8+6×1/2=4,即每个晶胞平均占有4个Ca2+,故B正确;
C.在石墨晶体中,每个碳环为正六边形,碳环中每个碳原子为3个碳环共用,所以环上平均占有6×1/3=2个碳原子,故C不正确;
D.银晶体是面心立方堆积,采用沿X、Y、Z三轴切割的方法知,每个平面上银原子的配位数是4,三个面共有4×3=12个银原子,所以每个银原子的配位数是12,故D正确,
故选C。

【题目】以下是一些元素的信息,其中有一种元素不在短周期。
元素A | 元素B | 元素C | 元素X | 元素Y |
单质是一种常见金属,与元素X形成黑色和红棕色三种常见化合物 | 基态原子M层p轨道上有5个电子 | 短周期中金属性最强,与X反应能生成两种常见化合物 | 最外层电子数是内层电子数的3倍,能形成双原子阴离子 | 单质为双原子分子,结构中σ键与π数目比为1:2 |
根据上述信息回答下列问题:
(1)写出X3的等电子体_____(写一个即可),基态Y原子核外电子所占据的最高能级的电子云形状为______。
(2)A元素在元素周期表中的___区,基态A原子的未成对电子有___个。
(3)B、C、X的简单离子半径由大到小的顺序为______(填离子符号)。
(4)HX与HY两种共价键中,键的极性较强的是____,键长较长的是____(X、Y用元素符号表示)。
(5)Y与碳元素形成的一种阴离子与Y2是等电子体,请写出该阴离子的电子式___。Y的常见氢化物易溶于水的主要原因是___。
(6)铂丝蘸取化合物CB在酒精灯上灼烧,火焰呈___色,显色原因是___(填序号)。
A.CB受热挥发 B.CB受热分解
C.C离子中电子跃迁 D.B离子中电子跃迁