题目内容
【题目】实验室常用锌粒与盐酸反应制取H2,下列措施不能提高该反应反应速率的是
A.用水将盐酸稀释B.用锌粉代替锌粒
C.适当提高盐酸浓度D.向反应液中滴入少量CuCl2溶液
【答案】A
【解析】
A.用水将盐酸稀释,氢离子浓度减小,反应速率降低,A符合题意;
B.将锌粒改为锌粉,固体表面积增大,反应速率增大,B不符合题意;
C.适当提高盐酸浓度,氢离子浓度增大,反应速率增大,C不符合题意;
D.锌置换出铜,形成铜锌原电池反应,反应速率增大,D不符合题意;
答案选C。

【题目】含氮化合物在工农业生产中都有重要应用。
(1)氮和肼(N2H4)是两种最常见的氮氢化物。
已知:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH1=-541.8 kJ·mol-1,化学平衡常数为K1。N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8 kJ·mol-1,化学平衡常数为K1。N2H4(g)+O2(g)![]() N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为__________________,该反应的化学平衡常数K=________(用K1、K2表示)。
N2(g)+2H2O(g) ΔH2=-534 kJ·mol-1,化学平衡常数为K2。则用NH3和O2制取N2H4的热化学方程式为__________________,该反应的化学平衡常数K=________(用K1、K2表示)。
(2)对于2NO(g)+2CO(g)![]() N2(g)+2CO2(g),在一定温度下,于1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1 L的恒容密闭容器中充入0.1 mol NO和0.3 mol CO,反应开始进行。
①下列能说明该反应已经达到平衡状态的是______(填字母代号)。
A.c(CO)=c(CO2)
B.容器中混合气体的密度不变
C.v(N2)正=2v(NO)逆
D.容器中混合气体的平均摩尔质量不变
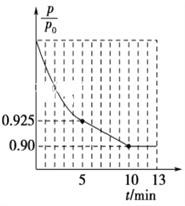
②图1为容器内的压强(p)与起始压强(p0)的比值![]() 随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)=________,平衡时NO的转化率为________。
随时间(t)的变化曲线。0~5min内,该反应的平均反应速率v(N2)=________,平衡时NO的转化率为________。
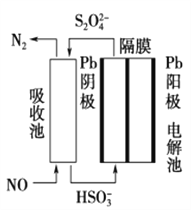
(3)使用间接电化学法可处理燃烧烟气中的NO,装置如图所示。已知电解池的阴极室中溶液的pH在4~7之间,写出阴极的电极反应式:____________________。用离子方程式表示吸收池中除去NO的原理____________________________________________。
【答案】 4NH3(g)+O2(g)2N2H4(g)+2H2O(g)ΔH=+526.2 kJ·mol-1 K1/K22 D 0.006 mol·L-1·min-1 80% 2HSO3-+2e-+2H+===S2O42-+2H2O 2NO+2S2O42-+2H2O===N2+4HSO3-
【解析】(1)①4NH3(g)+3O2(g) ![]() 2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。②N2H4(g)+O2(g)
2N2(g)+6H2O(g) ΔH1=-541.8kJ/mol,化学平衡常数为K1。②N2H4(g)+O2(g) ![]() N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。根据盖斯定律,将①-②×2得:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=(-541.8kJ/mol)-(-534kJ/mol)×2=+526.2kJ/mol,该反应的化学平衡常数K=
N2(g)+2H2O(g) ΔH2=-534kJ/mol,化学平衡常数为K2。根据盖斯定律,将①-②×2得:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=(-541.8kJ/mol)-(-534kJ/mol)×2=+526.2kJ/mol,该反应的化学平衡常数K=![]() ,故答案为:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=+526.2kJ/mol;
,故答案为:4NH3(g)+O2(g) = 2N2H4(g)+2H2O(g) ΔH=+526.2kJ/mol; ![]() ;
;
(2)对于2NO(g)+2CO(g) ![]() N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
N2(g)+2CO2(g),在一定温度下,于1L的恒容密闭容器中充入0.1molNO和0.3molCO,反应开始进行。
①A.c(CO)=c(CO2),不表示浓度变化,不能判断是否为平衡状态,故A错误;B.反应中气体的质量不变,体积不变,容器中混合气体的密度始终不变,不能判断是否为平衡状态,故B错误;C.v(N2)正=2v(NO)逆表示,应该是2v(N2)正=v(NO)逆,才表示正逆反应速率相等,故C错误;D.该反应属于气体的物质的量发生变化的反应,容器中混合气体的平均摩尔质量不变时表示气体的物质的量不变, 说明是平衡状态,故D正确;故选D;
②根据容器内的压强(P)与起始压强(P0)的比值(P/P0)随时间(t)的变化曲线,0~5min内,![]() =0.925,根据阿伏伽德罗定律及其推论,
=0.925,根据阿伏伽德罗定律及其推论,![]() =0.925,平衡时
=0.925,平衡时![]() =0.90,
=0.90,
2NO(g)+ 2CO(g) ![]() N2(g)+2CO2(g)
N2(g)+2CO2(g)
起始(mol) 0.1 0.3 0 0
反应 2x 2x x 2x
5min及平衡 0.1-2x 0.3-2x x 2x
5min时,![]() =0.925,解得x=0.03mol,v(N2)=
=0.925,解得x=0.03mol,v(N2)=![]() = 0.006mol·L-1·min-1;平衡时,
= 0.006mol·L-1·min-1;平衡时,![]() =0.90,解得x=0.04mol,NO的转化率=
=0.90,解得x=0.04mol,NO的转化率=![]() ×100%=80%,故答案为:0.006 mol·L-1·min-1;80%;
×100%=80%,故答案为:0.006 mol·L-1·min-1;80%;
(3)阴极发生还原反应,是亚硫酸氢根离子,得电子,生成硫代硫酸根离子,电极反应式为:2HSO3-+2e-+2H+═S2O42-+2H2O;硫代硫酸根离子与一氧化氮发生氧化还原反应,生成氮气,离子反应方程式为:2NO+2S2O42-+2H2O═N2+4HSO3-;故答案为:2HSO3-+2H++2e-=S2O42-+2H2O;2NO+2S2O42-+2H2O=N2+4HSO3-。
【题型】填空题
【结束】
10
【题目】锂离子电池是目前具有最高比能量的二次电池。LiFePO4可极大地改善电池体系的安全性能,且具有资源丰富、循环寿命长、环境友好等特点,是锂离子电池正极材料的理想选择。生产LiFePO4的一种工艺流程如图:
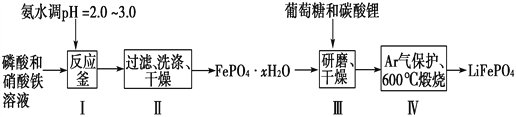
已知:Ksp(FePO4·xH2O)=1.0×10-15,Ksp[Fe(OH)3]=4.0×10-38。
(1)在合成磷酸铁时,步骤Ⅰ中pH的控制是关键。如果pH<1.9,Fe3+沉淀不完全,影响产量;如果pH>3.0,则可能存在的问题是________________。
(2)步骤Ⅱ中,洗涤是为了除去FePO4·xH2O表面附着的________等离子。
(3)取3组FePO4·xH2O样品,经过高温充分煅烧测其结晶水含量,实验数据如下表:
实验序号 | 1 | 2 | 3 |
固体失重质量分数 | 19.9% | 20.1% | 20.0% |
固体失重质量分数=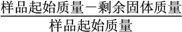 ×100%,则x=_______(精确至0.1)。
×100%,则x=_______(精确至0.1)。
(4)步骤Ⅲ中研磨的作用是__________________________________。
(5)在步骤Ⅳ中生成了LiFePO4、CO2和H2O,则氧化剂与还原剂的物质的量之比为________。
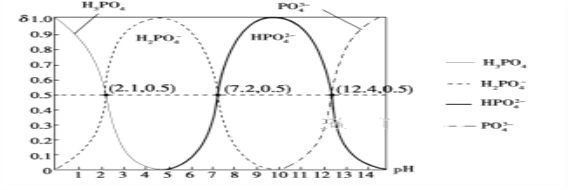
(6)H3PO4是三元酸,如图是常温下溶液中含磷微粒的物质的量分数(δ)随pH变化示意图。则PO![]() 第一步水解的水解常数K1的表达式为______,K1的数值最接近______(填字母)。
第一步水解的水解常数K1的表达式为______,K1的数值最接近______(填字母)。
A.10-12.4 B.10-1.6 C.10-7.2 D.10-4.2
【题目】请按要求回答下列问题:
I.25℃时,物质的量浓度均为0.1mol/L的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | Na2CO3 |
pH | 5 | 7 | 8.4 | 11.6 |
(1)用离子方程式解释溶液④能去除油污的原因________________________。
(2)写出溶液③中电荷守恒的关系式:_________________________________________。
(3)25℃时,溶液①中,由水电离产生的c(OH-)=_______mol/L;
根据溶液②,Ka(CH3COOH )_____Kb(NH3·H2O) (填“>”、“<”或“=”)。
II.根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2) 表面与水发生下列反应,
(1)已知: N2(g) + 3H2(g)![]() 2NH3(g) △H=-92.4kJ·mol-1
2NH3(g) △H=-92.4kJ·mol-1
2H2(g) + O2(g)= 2H2O (1) △H =-571.6kJ·mol-1
则2N2(g) + 6H2O(1)![]() 4NH3(g) + 3O2(g) △H=______。
4NH3(g) + 3O2(g) △H=______。
(2)氮化硅(Si3N4)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得: 3SiO2(s)+ 6C(s) + 2N2(g) ![]() Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
Si3N4(s)+ 6CO(g)。该反应的平衡常数表达式为K=_________。
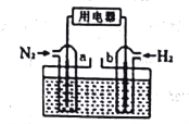
(3)以N2和H2为反应物(如下图),盐酸酸化的NH4Cl溶液为电解质的原电池,a电极的电极反应式为:____________________________________________。