题目内容
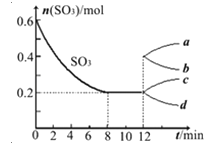
【题目】某化学研究性学习小组对某Na2CO3和NaHCO3的混合溶液的组成进行探究,取20.0mL该混合溶液,向其中不断加入1.00mol·L﹣1的稀盐酸,加入稀盐酸的体积和产生的现象如表中所示.
反应阶段 | Ⅰ | Ⅱ | Ⅲ |
稀盐酸体积x/mL | 0<x≤10.0 | 10.0<x≤40.0 | x>40.0 |
现 象 | 无气体 | 有气体 | 无气体 |
则混合溶液中c(HCO3﹣)为( )
A. 1.00mol·L﹣1 B. 0.50mol·L﹣1 C. 1.50mol·L﹣1 D. 2.00mol·L﹣1
【答案】A
【解析】
第Ⅰ阶段无气体生成说明盐酸滴入溶液中发生的是碳酸根离子和氢离子生成碳酸氢根离子的过程,反应为CO32-+H+=HCO3-,消耗盐酸体积10ml,碳酸钠全部转化为碳酸氢钠,氯化氢物质的量为:0.010ml×1.00molL-1=0.01mol,则反应生成碳酸氢根离子的物质的量为0.01mol,第Ⅱ阶段发生反应:HCO3-+H+=H2O+CO2↑,则参加反应的碳酸氢根离子的总物质的量为:(0.04L-0.01L)×1.00mol/L=0.03mol,则原溶液中碳酸氢根离子的物质的量为:0.03mol-0.01mol=0.02mol,所以原混合液中碳酸氢根离子的浓度为:c(HCO3-)=![]() =1mol/L,故选A。
=1mol/L,故选A。

 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外接电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚。其反应原理如下:
铅蓄电池:Pb(s)+PbO2(s)+2H2SO4(aq)==2PbSO4(s)+2H2O(l);
电解池:2Al+3H2O![]() Al2O3+3H2↑
Al2O3+3H2↑
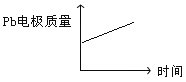
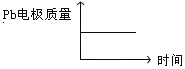
电解过程中,以下各组判断正确的是( )
铅蓄电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e-=Pb2++2H2O | 阳极:2Al+3H2O-6e-=Al2O3+6H+ |
D |
|
|
A. A B. B C. C D. D