题目内容
【题目】草酸钴是制作氧化钴和金属钴的原料,一种利用含钴废料(主要成分为Co2O3,含少量Fe2O3、ZnO、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下:
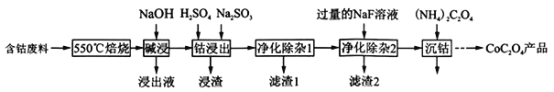
已知:ZnO与Al2O3化学性质相似,既能溶于强酸又能溶于强碱
(1)“550℃焙烧”的目的是______________________;
(2)“浸出液”的主要成分是_____________________;
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为_____________________;
(4) “净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是____________________ (用离子方程式表示);再升温至80~85℃,加入___________溶液,调pH至4.5以达到净化除杂的目的。
(5)“净化除杂2”过程中,若溶液c(Ca2+)=0.01mol/L,使Mg2+恰好沉淀完全即溶液中c(Mg2+)=1.0×10-5mol/L,此时是否有CaF2沉淀生成________________?(列式计算)[已知Ksp(MgF2) =7.0×10-11、Ksp(CaF2) =1.0×10-10]。
(6)为测定制得样品的纯度,现称取1.000g样品,将其用适当试剂转化,得到草酸铵[(NH4)2C2O4]溶液,再用过量稀硫酸酸化,用0. 1000 mol/L KMnO4溶液滴定,达到滴定终点时,共用去KMnO4溶液26.00 mL,则草酸钴样品的纯度为__________________。
【答案】 除去碳和有机物 NaAlO2、Na2ZnO2 2Co3++SO32-+H2O=2Co2++SO42-+2H+ 2Fe2++2H++H2O2=2Fe3++2H2O Na2CO3(NaOH、CoCO3也对) Mg2+恰好沉淀完全时,c2(F+)=Ksp[MgF2]/c(Mg2+)=7.0×10-6,所以Qc=c2(F+)×c(Ca2+)=7.0×10-6×0.01=7.0×10-8>K sp[CaF2],因此会生成CaF2沉淀 95.55%
【解析】本题主要考查对于“一种利用含钴废料制取CoC2O4的工艺流程”的评价。
(1)“550℃焙烧”的目的是除去碳和有机物;
(2)“浸出液”的主要成分是ZnO与Al2O3溶于氢氧化钠溶液生成的NaAlO2、Na2ZnO2;
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为2Co3++SO32-+H2O=2Co2++SO42-+2H+;
(4) “净化除杂1”过程中,先在40 ~ 50℃加入H2O2,其作用是将亚铁离子氧化为铁离子,2Fe2++2H++H2O2=2Fe3++2H2O;再升温至80~85℃,加入Na2CO3(NaOH、CoCO3也对)溶液,调pH至4.5以达到净化除杂的目的。
(5)Mg2+恰好沉淀完全时,c2(F+)=Ksp[MgF2]/c(Mg2+)=7.0×10-6,所以Qc=c2(F+)×c(Ca2+)=7.0×10-6×0.01=7.0×10-8>K sp[CaF2],因此会生成CaF2沉淀
(6)5CoC2O4~5(NH4)2C2O4~2KMnO4,草酸钴样品的纯度为0.1000mol/L×26.00mL×5/2×147g/mol/1.000g=95.55%。

【题目】除去混合物中的杂质(括号中为杂质),所选试剂和分离方法都正确的是
混合物 | 除杂试剂 | 分离方法 | |
A | 乙烷(乙烯) | Br2(CCl4) | 洗气 |
B | 乙醇(水) | 生石灰 | 过滤 |
C | 硝基苯(HNO3) | NaOH溶液 | 分液 |
D | 溴苯(溴) | CCl4 | 萃取 |
A.AB.BC.CD.D