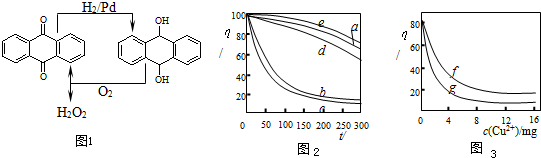
题目内容
8.根据下列条件,回答相关问题:已知:①P4(g)+6Cl2(g)═4PCl3(g)△H=a kJ•mol-1
P4(g)+10Cl2(g)═4PCl5(g)△H=b kJ•mol-1
②几种化学键的键能数据如下(键能指断裂1mol气态化学键生成气态原子吸收的能量)
| 化学键 | Cl-Cl | PCl3中P-Cl键 | PCl5中P-Cl键 |
| 键能/kJ•mol-1 | d | 1.2c | c |
(1)断裂1mol PCl5(g)中化学键吸收能量比断裂1mol PCl3(g)中化学键吸收能量多0.2c.
(2)1mol P4分子中含有6mol P-P键,P-P键的键能为(a-6d+4.8c)kJ•mol-1.
(3)分开上述数据,能否计算Cl2(g)+PCl3(g)═PCl5(g)的反应热△H?若不能计算,缺什么数据?
分析 (1)根据1mol PCl5(g)中含有化学键的能量和1mol PCl3(g)中含有化学键的能量判断;
(2)P4是正四面体结构,1mol P4分子中含有6molP-P键,根据焓变=旧键断裂吸收的能量-新键生成释放的能量计算回答;
(3)Cl2(g)+PCl3(g)═PCl5(g)的反应热△H=断裂1molCl-Cl键吸收的能量+断裂3molP-Cl键吸收的能量-形成5molP-Cl键释放的能量.
解答 解:(1)断裂1mol PCl5(g)中化学键吸收能量比断裂1mol PCl3(g)中化学键吸收能量多1.2c-c=0.2c,故答案为:0.2c;
(2)P4是正四面体结构,1mol P4分子中含有6molP-P键,已知:P4(g)+6Cl2(g)═4PCl3(g)△H=a kJ•mol-1,设P-P键的键能是x,得到:x+6d-4.8c=a,解得x=a-6d+4.8c,所以P-P键的键能是(a-6d+4.8c)kJ•mol-1,故答案为:6;(a-6d+4.8c)kJ•mol-1;
(3)Cl2(g)+PCl3(g)═PCl5(g)的反应热△H=断裂1molCl-Cl键吸收的能量+断裂3molP-Cl键吸收的能量-形成5molP-Cl键释放的能量=1.2c+d-c=0.2c+d,即Cl2(g)+PCl3(g)═PCl5(g)的反应热△H=(0.2c+d)kJ•mol-1;故答案为:(0.2c+d)kJ•mol-1.
点评 本题考查学生反应热和焓变的有关计算知识,注意焓变和键能之间的关系是计算的关键,难度中等.

练习册系列答案
 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
16.下列有关NaHCO3和Na2CO3的性质比较中,不正确的是( )
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 常温时,在水中的溶解度:Na2CO3>NaHCO3 | |
| C. | 等物质的量的NaHCO3和Na2CO3与足量稀盐酸反应产生CO2的质量:Na2CO3<NaHCO3 | |
| D. | NaHCO3和Na2CO3溶液的物质的量浓度相同时,溶液的pH:Na2CO3>NaHCO3 |
20.下列反应属于取代反应的是( )
| A. | Zn+CuSO4 ═ZnSO4+Cu | B. | NaCl+AgNO3═NaNO3+AgCl↓ | ||
| C. | CH3OH+HCOOH→HCOOCH3+H2O | D. | CH4+2Br2 $\stackrel{光照}{→}$ CH2Br2+2HBr |
1.下列有关化学用语等问题中不正确的是( )
| A. | CH4分子的比例模型: | B. | 2-甲基-1,3-丁二烯的键线式  | ||
| C. | 乙炔分子的电子式:H:C┇┇C:H | D. | 乙烯的结构简式:CH2CH2 |
 现有A、B、C、D、E五种短周期元素,已知:①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;②A、D同主族,A是所有元素中原子半径最小的元素;③通常状况下,A2、B2、C2三种单质均为常见无色气体;④B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素.请填写下列空白:
现有A、B、C、D、E五种短周期元素,已知:①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;②A、D同主族,A是所有元素中原子半径最小的元素;③通常状况下,A2、B2、C2三种单质均为常见无色气体;④B、D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素.请填写下列空白: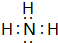
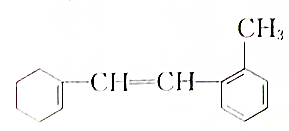 [典型例题√某有机物的结构简式如图:
[典型例题√某有机物的结构简式如图: