��Ŀ����
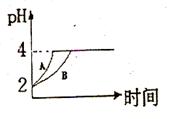
ͼ��A��B��������ֱ��ռ������ֻ������õ��������塣�����м������(��ͼ��)��������������������ֲ������������С�����һ�������������仯���Է����̡����ڴ˹��̵�����˵������ȷ����
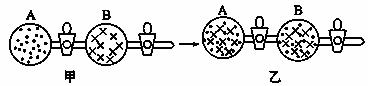
A.�˹���Ϊ���ҳ̶�С������ҳ̶ȴ�ķ���ı仯���̣���������Ĺ���
B.�˹���Ϊ�Է����̣�����û�����������ջ�ų�
C.�˹��̴����������Ҷ�����
D.�˹������Է������
D

��ϰ��ϵ�д�
�����Ŀ
 ��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ�����֣��Ҿ�������������ԭ������ش��������⣺
��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ�����֣��Ҿ�������������ԭ������ش��������⣺ ��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ�����֣��Ҿ�������������ԭ������ش��������⣺
��ѧѧ���е�ƽ��������Ҫ��������ѧƽ�⡢����ƽ�⡢ˮ��ƽ����ܽ�ƽ�����֣��Ҿ�������������ԭ������ش��������⣺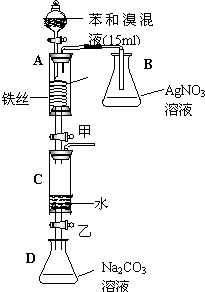 ��ͼ��ijУ�о���ѧϰС���ͬѧ��Ƶ��йر���������������ʱ��Ӧ��ʵ��װ��ͼ����ش��������⣺
��ͼ��ijУ�о���ѧϰС���ͬѧ��Ƶ��йر���������������ʱ��Ӧ��ʵ��װ��ͼ����ش��������⣺ 4C (g) ��H >0 �ﵽƽ��ʱ��c(A) ="2" mol��L-1��c ( B) =" 7" mol��L-1��c ( C) =" 4" mol��L-1����ȷ��B����ʼŨ��c (B)��ȡֵ��Χ�� �����ı��������´ﵽƽ�����ϵ��C�����������������д�ʩ���е��� ��
4C (g) ��H >0 �ﵽƽ��ʱ��c(A) ="2" mol��L-1��c ( B) =" 7" mol��L-1��c ( C) =" 4" mol��L-1����ȷ��B����ʼŨ��c (B)��ȡֵ��Χ�� �����ı��������´ﵽƽ�����ϵ��C�����������������д�ʩ���е��� ��