题目内容
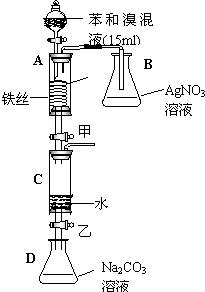 如图是某校研究性学习小组的同学设计的有关苯与溴在铁作催化剂时反应的实验装置图.请回答下列问题:
如图是某校研究性学习小组的同学设计的有关苯与溴在铁作催化剂时反应的实验装置图.请回答下列问题:(1)关闭甲乙两活塞后,打开分液漏斗的活塞,让苯和溴的混合液体慢慢滴在铁丝圈上,此时A中发生反应的化学方程式是
(2)分液漏斗中液体滴完后关闭活塞,然后打开甲活塞,让A装置下部储存的液体慢慢滴入盛有水的C装置中,此时看到的现象是
(3)当A中的液体滴完后,打开C装置中的乙活塞,使C容器里下部的液体慢慢放出5ml于D装置中,然后关闭乙活塞.振荡D,静置,可看到D中的现象是
(4)用什么方法分离D装置中的液体(填操作方法的名称)
(5)在(4)实验之后,要得到纯净的卤代物应采用方法是(填操作方法的名称)
分析:(1)写出苯与液溴在铁做催化剂反应的化学方程式;反应生成了溴化氢,管口有白雾生成,溴离子与银离子反应生成了溴化银沉淀;
(2)反应后生成的溴苯不溶于水,溴苯密度比水大,溶有溴的溴苯在下层;
(3)碳酸钠与溴反应,反应后溶液分层,溴单质消失,两层溶液都为变成无色;
(4)根据分离互不相溶的液体的操作方法判断;
(5)根据沸点不同可以通过蒸馏操作将相互溶液的液体分离,根据蒸馏操作使用的仪器进行解答.
(2)反应后生成的溴苯不溶于水,溴苯密度比水大,溶有溴的溴苯在下层;
(3)碳酸钠与溴反应,反应后溶液分层,溴单质消失,两层溶液都为变成无色;
(4)根据分离互不相溶的液体的操作方法判断;
(5)根据沸点不同可以通过蒸馏操作将相互溶液的液体分离,根据蒸馏操作使用的仪器进行解答.
解答:解:(1)关闭甲乙两活塞后,打开分液漏斗的活塞,让苯和溴的混合液体慢慢滴在铁丝圈上,苯和液溴发生了取代反应生成溴苯和溴化氢,反应的化学方程式:C6H6+Br2
C6H5Br+HBr;由于反应生成了溴化氢,在管口产生白雾,同时有淡黄色溴化银沉淀生成,反应的离子方程式为:Ag++Br-=AgBr↓,
故答案为:C6H6+Br2
C6H5Br+HBr;管口产生白雾,有淡黄色沉淀生成;Ag++Br-=AgBr↓;
(2)由于溴苯的密度大于水的密度,与水混合后溶液会分层,下层为褐色油状液体,上层液体淡黄色,
故答案为:液体分层,下层为褐色油状液体,上层液体淡黄色;
(3)碳酸钠与溴苯中的溴反应,溴苯混合液的颜色消失,反应后溶液分层,下层为无色油状液体(溴苯),上层液体无色(溴化钠和碳酸钠)
故答案为:液体分层,下层为无色油状液体,上层液体无色;
(4)可以通过分液操作将溶有苯的溴苯层与水溶液分离,
故答案为:分液;
(5)将溴苯中的苯分离,可以通过蒸馏的方法完成,蒸馏使用的仪器有:铁架台(带铁圈),石棉网,酒精灯,双孔橡胶塞,导气管,锥形瓶,接收管等,还需要蒸馏烧瓶、温度计、冷凝管,
故答案为:蒸馏;蒸馏烧瓶、温度计、冷凝管.
| Fe |
故答案为:C6H6+Br2
| Fe |
(2)由于溴苯的密度大于水的密度,与水混合后溶液会分层,下层为褐色油状液体,上层液体淡黄色,
故答案为:液体分层,下层为褐色油状液体,上层液体淡黄色;
(3)碳酸钠与溴苯中的溴反应,溴苯混合液的颜色消失,反应后溶液分层,下层为无色油状液体(溴苯),上层液体无色(溴化钠和碳酸钠)
故答案为:液体分层,下层为无色油状液体,上层液体无色;
(4)可以通过分液操作将溶有苯的溴苯层与水溶液分离,
故答案为:分液;
(5)将溴苯中的苯分离,可以通过蒸馏的方法完成,蒸馏使用的仪器有:铁架台(带铁圈),石棉网,酒精灯,双孔橡胶塞,导气管,锥形瓶,接收管等,还需要蒸馏烧瓶、温度计、冷凝管,
故答案为:蒸馏;蒸馏烧瓶、温度计、冷凝管.
点评:本题考查了苯的性质,题目难度中等,试题涉及的题量稍大,要求学生掌握苯的化学性质,本题能够培养学生的分析、理解能力及灵活应用所学知识解决实际问题的能力.

练习册系列答案
 优生乐园系列答案
优生乐园系列答案 新编小学单元自测题系列答案
新编小学单元自测题系列答案
相关题目
下表是某城市某日的空气质量报告:
该市某校研究性学习小组对表中首要污染物SO2导致酸雨的成因进行了如下探究:
(1)用如图所示装置进行实验.

①A装置的作用是 (填“干燥”或“氧化”)SO2气体.
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变 色,说明SO2与水反应生成一种酸.
③D装置的作用是 .D中发生反应的化学方程式是 .
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH 7(填“>”“=”或“<”),然后每隔1h测定其pH,发现pH逐渐 (填“变大”或“变小”),直至恒定.说明烧杯中的溶液被空气中的氧气氧化最终生成H2SO4.
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为 (填“催化剂’’或“氧化剂”).
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
(5)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为 ,是造成酸雨的另一主要原因.
| 污染指数 | 首要污染物 | 空气质量等级 | 空气质量状况 |
| 55 | SO2 | Ⅱ | 良 |
(1)用如图所示装置进行实验.

①A装置的作用是
②实验过程中,B装置内石蕊试纸的颜色没有发生变化,C装置内湿润的蓝色石蕊试纸变
③D装置的作用是
(2)往盛有水的烧杯中通入SO2气体,测得所得溶液的pH
(3)SO2形成酸雨的另一途径为:SO2与空气中的O2在飘尘的作用下反应生成SO3,SO3溶于降水生成H2SO4,则在此过程中的飘尘是作为
(4)SO2与空气中的氧气、水反应生成硫酸而形成酸雨.该市可能易出现酸雨.
(5)汽车排放的尾气,硝酸、化肥等工业生产排出的废气中都含有氮的氧化物,氮的氧化物溶于水最终转化为
 某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示:
某校研究性学习小组用相同大小的铜片和锌片为电极研究水果电池,得到的实验数据如表所示: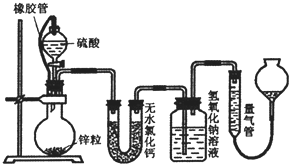 不同浓度的硫酸与锌反应时,硫酸可以被还原为S02,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.
不同浓度的硫酸与锌反应时,硫酸可以被还原为S02,也可被还原为氢气.某校研究性学习小组拟设计实验验证这一事实,并进行数据测定和相关计算.