题目内容
(20分)选修四模块的平衡理论主要包括:化学平衡、电离平衡、水解平衡和溶解平衡四种,且均符合勒夏特列原理。请回答下列问题:
(1) 一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g) +2B(g)  4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
A. 增加C的物质的量 B. 加压
C. 升温 D.使用催化剂
(2)常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是 ( 填“A”或“B”)。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 则
m1 m2 ( 选填“<”、“=”、“>”)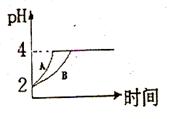
(3) 在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) ΔH= —91kJ·mol-1。反应达到平衡时,平衡常数表达式K= ,升高温度,K值 (填“增大”、“减小”或“不变”)。
(4) 难溶电解质在水溶液中也存在溶解平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数。例如: Cu(OH)2(s) Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使pH大于 ; 要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的万分之一)则应向溶液里加NaOH溶液,使溶液pH等于 。
Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使pH大于 ; 要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的万分之一)则应向溶液里加NaOH溶液,使溶液pH等于 。
(5) 常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色。则该溶液呈 性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。请你设计一个简单的实验方案用来评判甲乙两位同学的观点是否正确(包括操作、现象和结论) 。
1)[3 mol·L-1,9 mol·L-1] C
(2)B <
(3) C(CH3OH)/ [C( CO)*C 2(H2)] 减小
(4)5 7
(5) 碱 向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪色说明乙正确(其他试剂合理也给分)
解析试题分析:(1) 一定温度下,在一个固定容积的密闭容器中,可逆反应 A(g) +2B(g)  4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。
4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。
A(g) + 2B(g)  4C (g) △H >0
4C (g) △H >0
起始浓度 ①x+2 ① 2x+7 ① 4—4x
②2—x ② 7—2x ② 4x+4
反应浓度 x 2x 4x
平衡浓度 2 mol·L-1 7 mol·L-1 4 mol·L-1
①是从正向建立的平衡 所以4—4x≥0 所以x≤1 B的起始浓度c (B)=2x+7≤9
②是从逆向建立的平衡 所以2—x≥0 所以x≤2 B的起始浓度c (B)=7—2x≥3
由此确定B的起始浓度c (B)的取值范围是[3 mol·L-1,9 mol·L-1];若改变条件重新达到平衡后体系中C的质量分数增大,平衡一定要向正向移动,所以可行的措施是升温;常温下,取 pH=2的盐酸和醋酸溶液各100mL, 向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如右图所示。则图中表示醋酸溶液中pH变化曲线的是B,因为醋酸是弱酸,随着反应的进行,醋酸又会电离出氢离子,所以氢离子的变化不是很大,所以PH变化较缓慢。 设盐酸中加入的Zn质量为m1,醋酸溶液中加入的Zn质量为 m2。 因为随着反应进行,PH最终都是4说明酸都过量,而醋酸在反应过程中始终在电离氢离子,所以醋酸消耗的锌更多,所以m1<m2; 在体积为3L的密闭容器中,CO与H2在一定条件下反应生成甲醇:CO ( g) + 2H2( g) → CH3OH(g) ΔH= —91kJ·mol-1。反应达到平衡时,平衡常数表达式K=C(CH3OH)/ [C( CO)*C 2(H2)],升高温度,平衡向逆向移动,所以K值减小; 难溶电解质在水溶液中也存在溶解平衡。在常温下,溶液里各离子浓度以它们化学计量数为方次的乘积是一个常数,叫溶度积常数。例如: Cu(OH)2(s) Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使c (Cu2+ ) c 2(OH - ) ≥ 2×10 -20 已知c( Cu2+) ="0.02" mol·L-1所以c 2(OH - ) ≥1×10 -18
Cu2+ (aq) + 2OH - ( aq),Ksp =" c" (Cu2+ ) c 2(OH - ) =" 2×10" -20。当溶液中各离子浓度计量数方次的乘积大于溶度积时,则产生沉淀。若某CuSO4溶液里c( Cu2+) ="0.02" mol·L-1,如果生成Cu(OH)2沉淀,应调整溶液pH,使c (Cu2+ ) c 2(OH - ) ≥ 2×10 -20 已知c( Cu2+) ="0.02" mol·L-1所以c 2(OH - ) ≥1×10 -18
所以c (OH - ) ≥1×10 -9 所以使pH大于5;
要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全 ( 使Cu2+浓度降至原来的万分之一)则应向溶液里加NaOH溶液,同理可知要使溶液pH等于7;常温下,某纯碱(Na2CO3) 溶液中滴入酚酞,溶液呈红色。则该溶液呈碱性。在分析该溶液遇酚酞呈红色原因时,甲同学认为是配制溶液所用的纯碱样品中混有NaOH 所致;乙同学认为是溶液中Na2CO3电离出的CO32-水解所致。用此方法即可:向红色溶液中加入足量BaCl2溶液,如果溶液还显红色说明甲正确,红色褪色说明乙正确。
考点: 化学平衡 电离平衡 水解平衡 溶解平衡
点评:此题的计算关系比较多,关键是把握每一类的特点:
化学平衡的建立是以可逆反应为前提的。可逆反应是指在同一条件下既能正向进行又能逆向进行的反应。绝大多数化学反应都具有可逆性,都可在不同程度上达到平衡。化学平衡则是指在宏观条件一定的可逆反应中,化学反应正逆反应速率相等,反应物和生成物各组分浓度不再改变的状态。可用ΔrGm=ΣνΑμΑ=0判断,μA是反应中A物质的化学势。根据吉布斯自由能判据,当ΔrGm=0时,反应达最大限度,处于平衡状态。根据勒夏特列原理,如一个已达平衡的系统被改变,该系统会随之改变来抗衡该改变。
要注意的是电离平衡常数只用于弱电解质的计算。强电解质不适用。
弱电解质AXBY水溶液中达到电离平衡时:
AxBy XA+ +Y B-
XA+ +Y B-
则,K(电离)=[A+]X·[B-]Y/[AxBy]
式中[A+]、[B-]、[AB]分别表示A+、B-和AB在电离平衡时的物质的量浓度。【A+】X 表示A离子浓度的X次方,[B-]Y同理.
盐的水解反应:凡是组成盐的离子与水作用产生弱酸或弱碱,并改变溶液酸度的反应都叫做盐的水解反应
弱碱阳离子水解使溶液显酸性(氯化铵)
强碱阳离子,强酸酸根离子不水解(氯化钠)
弱酸酸根离子水解使溶液显碱性(碳酸钠)
盐水解产生酸或碱的速率与酸或碱电离的速率相等时即达到水解平衡。
该盐的酸性或者碱性越弱,越容易水解,而且水解的程度越大。
强酸弱碱盐显酸性,强碱弱酸盐显碱性,强酸强碱盐显中性。
满足三大守恒:
电荷守恒、物料守恒、质子守恒,其中质子守恒由电荷守恒和物料守恒联立方程式得出。
溶解平衡的特点是动态平衡 即溶解速率等于结晶速率 且不等于零
因此达到平衡时 溶质的质量一定不变 但形状可以改变 并且一定是饱和溶液
任何物质的溶解都伴随着相应的结晶过程。
物质最终是溶解还是结晶则是由V(溶解)与V(结晶)决定的:
当V溶解>V结晶:溶质溶解 形成不饱和溶液
当V溶解=V结晶:溶质不变 形成饱和溶液 “溶解平衡”
当V溶解<V结晶:溶质析出 形成饱和溶液
溶解平衡:V溶解=V结晶
①溶解和结晶还在不断进行,但两者速率相同,宏观上表现为不再溶解,达到饱和状态。
②溶解平衡是一种动态平衡.
③蒸发溶剂或改变温度,使V溶解≠V结晶,溶解平衡状态被破坏,宏观上溶液不再是饱和状态,会继续溶解溶质或析出溶质,直到重新建立新的溶解平衡.

 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案 4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
4C (g) △H >0 达到平衡时,c(A) ="2" mol·L-1,c ( B) =" 7" mol·L-1,c ( C) =" 4" mol·L-1。试确定B的起始浓度c (B)的取值范围是 ;若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是 。
 A. 增加C的物质的量 B. 加压
A. 增加C的物质的量 B. 加压