题目内容
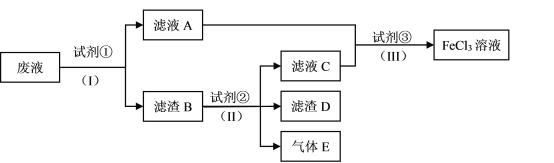
【题目】铅蓄电池的工作原理为Pb+PbO2+2H2SO4=2PbSO4+2H2O,研读如图,下列判断正确的是( )
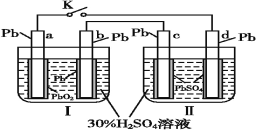
A.K闭合时,d电极的电极反应式:PbSO4+2e-=Pb+ SO42-
B.当电路中通过0.2 mol电子时,Ⅰ中消耗的H2SO4为0.2 mol
C.K闭合时,Ⅱ中SO42-向c电极迁移
D.K闭合一段时间后,Ⅱ可单独作为原电池,d电极为负极
【答案】B
【解析】
分析题给装置图,当K闭合时,Ⅰ为原电池,Ⅱ为电解池。结合原电池、电解池原理进行分析判断。
A.K闭合时,Ⅰ为原电池,根据铅蓄电池的工作原理,可知a电极为正极,b电极为负极,则Ⅱ中与a电极相连的d电极为阳极,发生氧化反应,电极反应方程式为:PbSO4+H2O-2e-=PbO2+SO42-+4H+;A项错误;
B.在上述总反应式中,得失电子总数为2e-,当电路中转移0.2mol电子时,可以计算出Ⅰ中消耗的硫酸的量为0.2mol,B项正确;
C.K闭合时,Ⅱ中c电极与Ⅰ中原电池的负极相连,则c电极为阴极,根据电解池原理,阳离子移向阴极,阴离子移向阳极,可知,C项错误;
D.K闭合一段时间,也就是充电一段时间后Ⅱ可以作为原电池,由于c表面生成Pb,放电时做电源的负极,d表面生成PbO2,做电源的正极,D项错误;
答案选B。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
【题目】下列“实验结论”与“实验操作及现象”相符的一组是( )
选项 | 实验操作及现象 | 实验结论 |
A | 向某溶液中加入 | 该溶液中一定含有 |
B | 向某溶液中加入稀盐酸,有无色气体产生 | 该溶液中一定含有 |
C | 向某溶液中加入 | 该溶液中一定含有 |
D | 向某溶液中加入 | 该溶液中一定含有 |
A.AB.BC.CD.D