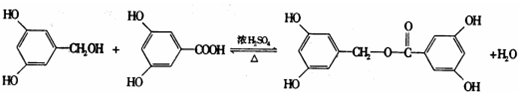
题目内容
18.萨罗(Salol)是一种消毒剂,它的分子式为C13H10O3.其分子模型如图1所示: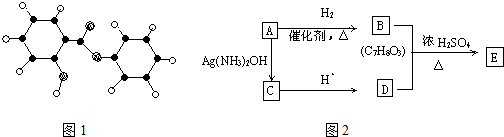
(图1中球与球之间的连线代表化学键,如单键、双键等).
(1)根据图1模型写出萨罗的结构简式:

(2)萨罗经水解、分离、提纯可得到纯净的苯酚和水杨酸(邻羟基苯甲酸).请设计一个方案,说明苯酚、碳酸、水杨酸的酸性依次增强(用化学方程式表示)
 .
.(3)同时符合下列四个要求的水杨酸的同分异构体共有2种.
①含苯环; ②能发生银镜反应,不能发生水解反应; ③在稀NaOH溶液中,1mol该同分异构体能与2mol NaOH发生反应; ④只能生成两种一氯代产物.
(4)从(3)确定的同分异构体中任选一种,指定为图2中的A.写出下列两个反应的化学方程式(有机物用结构简式表示),并指明相应的反应类型.
①A→B
 ;反应类型:加成反应.
;反应类型:加成反应.②B+D→E
 ;反应类型:酯化反应
;反应类型:酯化反应(5)现有水杨酸和苯酚的混合物,它们的物质的量之和为n mol,该混合物完全燃烧消耗aL CO2,并生成bg H2O和c L CO2(气体体积均为标准状况下的体积).
①分别写出水杨酸和苯酚完全燃烧的化学方程式(有机物可用分子式表示);C7H6O3+7O2$\stackrel{点燃}{→}$7CO2+3H2O,C6H6O+7O2$\stackrel{点燃}{→}$6CO2+3H2O.
②设混合物中水杨酸的物质的量为x mol,列出x的计算式.
分析 (1)萨罗的分子式为C13H10O3,由分子式可知,模型中黑色球代表碳元素,白色球代表氢原子,斜线白色球为氧原子.根据碳的四价结构,可知结构中环为苯环,根据氧原子的二价结构可知,连接两个苯环的基团为酯基,有1个-OH连接苯环;
(2)根据强酸制弱酸设计,羧酸酸性比碳酸强,碳酸酸性比苯酚强;
(3)水杨酸为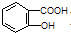 .根据题意知,该有机物中含有-CHO,不含酯的结构,含有两个与苯环相连的羟基;
.根据题意知,该有机物中含有-CHO,不含酯的结构,含有两个与苯环相连的羟基;
(4)选择A为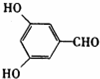 ,由关系图可知,B为
,由关系图可知,B为 ,D为
,D为 ,E为
,E为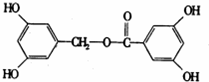 ,
,
①A→B只有醛基与氢气发生加成反应;②B+D→E 发生酯化反应;
(5)①分别写出水杨酸和苯酚完全燃烧生成二氧化碳与水;
②设混合物中水杨酸的物质的量为x mol,则苯酚为(n-x)mol,根据方程式表示出二氧化碳的物质的量,列出x的计算式.
解答 解:(1)萨罗的分子式为C13H10O3,由分子式可知,模型中黑色球代表碳元素,白色球代表氢原子,斜线白色球为氧原子.根据碳的四价结构,可知结构中环为苯环,根据氧原子的二价结构可知,连接两个苯环的基团为酯基,有1个-OH连接苯环.所以萨罗的结构简式 ,
,
故答案为: ;
;
(2))要证明酸的相对强弱,一般利用强酸与弱酸的盐反应,故可利用下列反应来证明三者的相对强弱: ,
,
故答案为: ;
;
(3)能发生银镜反应证明有醛基,不能发生水解反应说明无酯基,1 mol该同分异构体能与2 mol NaOH发生反应则说明有两个酚羟基,只能生成两种一氯代产物说明具有较好的对称性,符合条件的同分异构体有如下两种: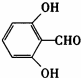 和
和 ,故答案为:2;
,故答案为:2;
(4)选择A为 ,由关系图可知,B为
,由关系图可知,B为 ,D为
,D为 ,E为
,E为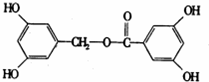 ,
,
①A→B只有醛基与氢气发生加成反应,反应方程式为 ,
,
故答案为: ;加成反应;
;加成反应;
②B+D→E 发生酯化反应,反应方程式为 ,
,
故答案为: ;酯化反应;
;酯化反应;
(5)现有水杨酸和苯酚的混合物,它们的物质的量之和为n mol.该混合物完全燃烧消耗a L O2,并生成b g H2O和c L CO2(气体体积均为标准状况下的体积).
①水杨酸和苯酚完全燃烧都生成二氧化碳与水,方程式分别为C7H6O3+7O2$\stackrel{点燃}{→}$7CO2+3H2O,C6H6O+7O2$\stackrel{点燃}{→}$6CO2+3H2O,
故答案为:C7H6O3+7O2$\stackrel{点燃}{→}$7CO2+3H2O,C6H6O+7O2$\stackrel{点燃}{→}$6CO2+3H2O;
②设混合物中水杨酸的物质的量为x mol,列出x的计算式
C7H6O3 +7O2$\stackrel{点燃}{→}$7CO2+3H2O,
x mol 7x mol
反应C6H6O+7O2$\stackrel{点燃}{→}$6CO2+3H2O
(n-x)mol 6(n-x)mol
所以7x+6(n-x)=$\frac{c}{22.4}$.
故答案为:7x+6(n-x)=$\frac{c}{22.4}$.
点评 本题主要是考查有机合成与推断,为高考常见题型和高频考点,侧重于学生的分析、计算能力的考查,着重考查有机物性质探究,有机反应类型研究,有机化学实验设计,同分异构体探究,有机反应计算等问题的综合题.难度较大,注意(5)中可以有不同形式的表达式.

 名校课堂系列答案
名校课堂系列答案| X | Y | Z | |
| A | Cl2 | SO2 | BaCl2 |
| B | NH3 | O2 | Al2(SO4)3 |
| C | NH3 | CO2 | MgCl2 |
| D | CO2 | SO2 | CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 浓硝酸使紫色石蕊试液先变红后褪色--酸性和强氧化性 | |
| B. | 不能用稀硝酸与锌反应制氢气--强氧化性 | |
| C. | 要用棕色瓶盛装浓硝酸--不稳定性 | |
| D. | 能使滴有酚酞的氢氧化钠溶液红色褪去--强氧化性 |
| 操 作 | 现 象 |
| 取4g漂粉精固体,加入100mL水 | 部分固体溶解,溶液略有颜色 |
| 过滤,测漂粉精溶液的pH | pH试纸先变蓝(约为12),后褪色 |
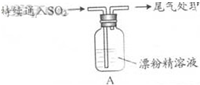 | i.液面上方出现白雾; ii.稍后,出现浑浊,溶液变为黄绿色; iii.稍后,产生大量白色沉淀,黄绿色褪去 |
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是碱性、漂白性.
(3)向水中持续通入SO2,未观察到白雾.推测现象i的白雾由HCl小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀.
①实验a目的是检验白雾中是否含有Cl2,排除Cl2干扰.
②由实验a、b不能判断白雾中含有HC1,理由是白雾中含有SO2,SO2可以使酸化的AgNO3溶液产生白色沉淀
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应.通过进一步实验确认了这种可能性,其实验方案是向漂粉精溶液中逐滴滴入硫酸,观察溶液颜色是否变为黄绿色
(5)将A瓶中混合物过滤、洗涤,得到沉淀X.
①向沉淀X中加入稀HC1,无明显变化.取上层清液,加入BaC12溶液,产生白色沉淀.则沉淀X中含有的物质是CaSO4.
②用离子方程式解释现象iii中黄绿色褪去的原因:Cl2+SO2+2H2O=4H++2Cl-+SO42-.
| A. | 明矾净水过程中不涉及化学变化 | B. | 金属与盐溶液反应都是置换反应 | ||
| C. | 化合反应一定有单质参加反应 | D. | 石油分馏和碘的升华都是物理变化 |
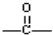
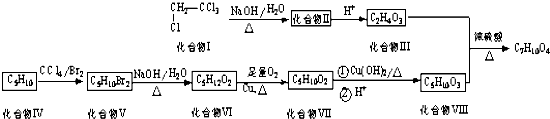
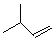
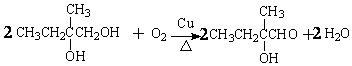 .
. ,该六元环酯(C7H10O4)的结构简式为
,该六元环酯(C7H10O4)的结构简式为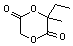 .
. ;
;