题目内容
8.下列各组物质中,气体X和气体Y同时通入盛有溶液Z的洗气瓶中,一定没有沉淀生成的是( )| X | Y | Z | |
| A | Cl2 | SO2 | BaCl2 |
| B | NH3 | O2 | Al2(SO4)3 |
| C | NH3 | CO2 | MgCl2 |
| D | CO2 | SO2 | CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、氯气和二氧化硫反应生成硫酸根离子;
B、氨气溶于水生成氨水,电离出氢氧根离子能够和铝离子生成氢氧化铝沉淀;
C、氨气溶于水生成氨水,氨水和二氧化碳反应生成碳酸根离子;
D、二氧化碳与二氧化硫不反应,也不能与氯化钙反应.
解答 解:A、氯气能够和二氧化硫反应生成硫酸根离子,硫酸根离子和钡离子生成硫酸钡生成,故A不选;
B、由于氨气溶于水生成了氨水,氨水和铝离子生成氢氧化铝沉淀,故B不选;
C、氨气极易溶于水生成氨水,氨水和二氧化碳反应生成碳酸铵,碳酸铵和硫酸镁反应生成碳酸镁白色沉淀,故C不选;
D、由于两种气体相互不反应,也不与氯化钙反应,故D选;
故选D.
点评 本题考查了氯气、二氧化硫、氨气的化学性质,注重了基础知识考查,难度不大.

练习册系列答案
相关题目
9.同分异构体现象在有机化学中是非常普遍的,下列有机物互为同分异构体的是( )
①CH2=CHCH3
②
③CH3CH2CH3
④HC≡CCH3
⑤
⑥H3CH=CHCH2CH3 .
①CH2=CHCH3
②

③CH3CH2CH3
④HC≡CCH3
⑤

⑥H3CH=CHCH2CH3 .
| A. | ⑤和⑥ | B. | ①和③ | C. | ①和④ | D. | ①和② |
10.用铝箔包裹0.1mol金属钠,用针孔扎出一些小孔,将其放入水中充分反应,下列有关叙述正确的是( )
| A. | 反应生成了1.12L(标准状况)H2 | |
| B. | 向反应后的溶液中加入足量小苏打,最终有白色沉淀生成 | |
| C. | 在反应后的溶液中一定能大量共存的粒子有:K+、Mg2+、I-、NO3- | |
| D. | 向反应后的溶液中加入足量稀硫酸,最终有白色沉淀生成 |
16.随着科技的飞速发展,出现了许多新型无机材料,如植入生物体内的生物陶瓷材料HAP[化学式为Cam(PO4)n(OH)2],已被医疗上用于修补人的骨骼和牙组织,HAP的化学式中m等于( )
| A. | $\frac{3n+2}{2}$ | B. | $\frac{3n-2}{2}$ | C. | $\frac{2n-2}{3}$ | D. | n+1 |
20.下列各组物质的稀溶液相互反应,无论是前者滴入后者,还是后者滴入前者,反应现象都相同的是( )
| A. | Na2CO3和H2SO4 | B. | AlC13和NaOH | C. | NaAlO2和H2SO4 | D. | NaHCO3和Ba(OH)2 |
17.25℃时,在pH=2的溶液中能大量共存的离子组是( )
| A. | Fe3+、Mg2+、SO42-、Cl- | B. | Ba2+、K+、I-、NO3- | ||
| C. | Fe2+、Cu2+、AlO2-、ClO- | D. | Na+、Ca2+、Cl-、CO32- |
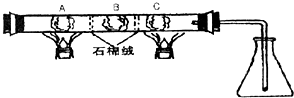 在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.
在一硬质玻璃管中进行如图所示的实验,图中A为NH4HCO3,B为Na2O2,C为Pt丝;石棉绒起隔离药品的作用.充分反应后,发现锥形瓶内出现红棕色气体,随之又有白烟产生.
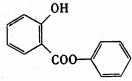
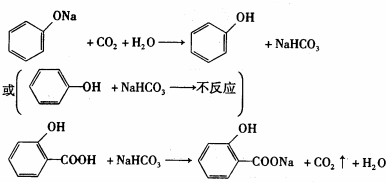 .
. ;反应类型:加成反应.
;反应类型:加成反应. ;反应类型:酯化反应
;反应类型:酯化反应