题目内容
下表为元素周期表的一部分,请回答有关问题
(1)⑤和⑧的元素符号是
(2)表中最活泼的金属是
(3)表中能形成两性氢氧化物的元素是
(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
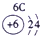
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
Si
Si
和Ar
Ar
;(2)表中最活泼的金属是
K
K
,非金属性最强的元素是F
F
;(填写元素符号)(3)表中能形成两性氢氧化物的元素是
Al
Al
,分别写出该元素的氢氧化物与⑥、⑨的最高价氧化物对应水化物反应的化学方程式:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O
,Al(OH)3+KOH=KAlO2+2H2O
Al(OH)3+KOH=KAlO2+2H2O
;(4)请设计一个实验方案,比较⑦、⑩单质氧化性的强弱:
在NaBr溶液中滴加Cl2水,若溶液加深(有红棕色形成),说明Cl2的氧化性比Br2强
在NaBr溶液中滴加Cl2水,若溶液加深(有红棕色形成),说明Cl2的氧化性比Br2强
.分析:(1)根据元素周期表,可确定①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩元素分别为:N、F、Mg、Al、Si、S、Cl、Ar、K、Br;
(2)又知金属性:同周期从左到右越来越小,同主族从上到下越来越大;而非金属性:同周期从左到右越来越大,同主族从上到下越来越小;
(3)氢氧化铝为两性化合物,既能与酸反应,又能与碱反应;
(4)利用“在氧化还原反应中,氧化剂氧化性大于氧化产物”原理,设计反应Cl2+2NaBr=2NaCl+Br2.
(2)又知金属性:同周期从左到右越来越小,同主族从上到下越来越大;而非金属性:同周期从左到右越来越大,同主族从上到下越来越小;
(3)氢氧化铝为两性化合物,既能与酸反应,又能与碱反应;
(4)利用“在氧化还原反应中,氧化剂氧化性大于氧化产物”原理,设计反应Cl2+2NaBr=2NaCl+Br2.
解答:解:(1)从5在元素周期表中的位置第三周期第ⅣA族可知⑤为元素硅Si;从8在元素周期表中的位置第三周期零族可知⑧为元素氩Ar,故答案为:Si;Ar;
(2)表中最活泼的金属应从元素周期表的左下角去找⑨应为元素钾K.非金属性最强的元素应从元素周期表的右上角去找,②应为元素氟F,故答案为:K;F;
(3)表中能形成两性氢氧化物的元素是④元素铝Al,⑥元素为S最高价氧化物的水化物为H2SO4,它与Al(OH)3反应的化学方程式为:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O以及
Al(OH)3+KOH=KAlO2+2H2O,
故答案为:Al;2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,Al(OH)3+KOH=KAlO2+2H2O;
(4)元素⑦为氯,元素⑩为溴,氯单质将溴离子氧化为溴单质就能证明氯化溴的氧化性强.将氯水加入到溴化钠溶液中,有红棕色的Br2生成,证明单质氯比单质溴氧化性强,
故答案为:在NaBr溶液中滴加Cl2水,若溶液加深(有红棕色形成),说明Cl2的氧化性比Br2强.
(2)表中最活泼的金属应从元素周期表的左下角去找⑨应为元素钾K.非金属性最强的元素应从元素周期表的右上角去找,②应为元素氟F,故答案为:K;F;
(3)表中能形成两性氢氧化物的元素是④元素铝Al,⑥元素为S最高价氧化物的水化物为H2SO4,它与Al(OH)3反应的化学方程式为:2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O以及
Al(OH)3+KOH=KAlO2+2H2O,
故答案为:Al;2Al(OH)3+3H2SO4=Al2(SO4)3+6H2O,Al(OH)3+KOH=KAlO2+2H2O;
(4)元素⑦为氯,元素⑩为溴,氯单质将溴离子氧化为溴单质就能证明氯化溴的氧化性强.将氯水加入到溴化钠溶液中,有红棕色的Br2生成,证明单质氯比单质溴氧化性强,
故答案为:在NaBr溶液中滴加Cl2水,若溶液加深(有红棕色形成),说明Cl2的氧化性比Br2强.
点评:关于元素周期律的考题一般难度都不大,做好该类型题目的关键是要准.要在头脑中有一个完整准确的元素周期表,这样就能准确判断元素,尽而回答出相关的问题.该题设计实验虽然简单,但体现了新课标的要求.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目









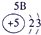
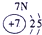
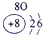
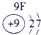
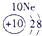
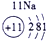





 表示的是
表示的是