题目内容
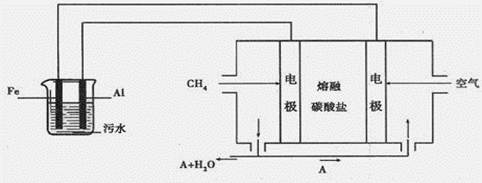
(10分)(1)为了验证Fe3 +与Cu2+氧化性强弱,下列装置能达到实验目的的是___________

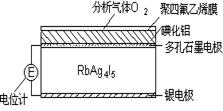
(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

①_______处电极入口通甲烷(填A或B),其电极反应式为_______________________________
_________________________________________
②当消耗甲烷的体积为22.4L(标准状况下)时, 假设电池的能量转化率为100%,则导线中转移电子的物质的量为 ,消耗KOH的物质的量为_____________________。

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

①_______处电极入口通甲烷(填A或B),其电极反应式为_______________________________
_________________________________________
②当消耗甲烷的体积为22.4L(标准状况下)时, 假设电池的能量转化率为100%,则导线中转移电子的物质的量为 ,消耗KOH的物质的量为_____________________。
(每空2分)(1)②
(2)①A ; CH4-8e-+10OH-=CO32-+7H2O
②8mol ; 2mol
(2)①A ; CH4-8e-+10OH-=CO32-+7H2O
②8mol ; 2mol
试题分析:(1)验证Fe3+与Cu2+氧化性强弱,在原电池中,铜作负极、其它导电的金属或非金属作正极,电解质溶液为可溶性的铁盐;①中铁作负极、Cu作正极,电池反应式为Fe+2Fe3+=3Fe2+,不能验证Fe3+与Cu2+氧化性强弱,故错误;②中铜作负极、银作正极,电池反应式为Cu+2Fe3+=Cu2++2Fe2+,能验证Fe3+与Cu2+氧化性强弱,故正确;③中铁发生钝化现象,Cu作负极、铁作正极,电池反应式为:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O,不能验证Fe3+与Cu2+氧化性强弱,故错误;④中铁作负极、铜作正极,电池反应式为:Fe+Cu2+=Cu+Fe2+,不能验证Fe3+与Cu2+氧化性强弱,故错误;故选②;
(2)①根据电子流向知,A为负极、B为正极,燃料电池中通入燃料的电极为负极、通入氧化剂的电极为正极,所以A处通入甲烷,甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH4-8e-+10OH-═CO32-+7H2O;
②甲烷的物质的量为1mol,导线中转移电子的物质的量=1mol×8=8mol,根据CH4-8e-+10OH-═CO32-+7H2O知,消耗KOH的物质的量为甲烷物质的量的10倍,所以消耗氢氧化钾的物质的量是10mol。

练习册系列答案
相关题目