题目内容
(14分)某含铬的污水可用下图所示装置处理,该装置可将污水中的Cr2O72-还原为Cr3+。
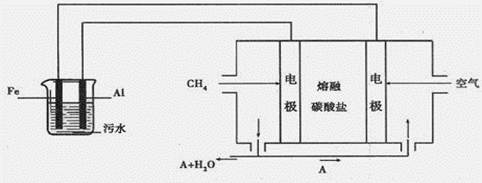
(1)图中左右两个装置中, (填“左”或“右”)装置为电解池。电源中负极的活性物质为 (填化学式);电源中两电极间,带负电荷的离子运动的方向为 (填“从左至右”或“从右到左”),该离子为 (填化学式)。
(2)请写出阳极上的电极反应式及Cr2O72-被还原为Cr3+的离子方程式分别是:
、 。
(3)为保证正常工作,图中A物质必须循环使用,其化学式为: 。
(4)镧系元素均为稀土元素(常用作电极)位于元素周期表第六周期,该周期元素形成的氢氧化物中碱性最强的为 (填写化学式)。铈(Ce)有两种氢氧化物Ce(OH)3和Ce(OH)4,前者对空气比较敏感,请用化学方程式表示其原因 。

(1)图中左右两个装置中, (填“左”或“右”)装置为电解池。电源中负极的活性物质为 (填化学式);电源中两电极间,带负电荷的离子运动的方向为 (填“从左至右”或“从右到左”),该离子为 (填化学式)。
(2)请写出阳极上的电极反应式及Cr2O72-被还原为Cr3+的离子方程式分别是:
、 。
(3)为保证正常工作,图中A物质必须循环使用,其化学式为: 。
(4)镧系元素均为稀土元素(常用作电极)位于元素周期表第六周期,该周期元素形成的氢氧化物中碱性最强的为 (填写化学式)。铈(Ce)有两种氢氧化物Ce(OH)3和Ce(OH)4,前者对空气比较敏感,请用化学方程式表示其原因 。
(14分)
⑴左(2’)。CH4(1’);从右到左(2’),CO32-(1’)
⑵Fe-2e-=Fe2+(2’)、6Fe2++Cr2O72-+11H2O=6Fe(OH)3↓+2Cr3++4H+(2’)
⑶CO2(1’)
⑷CsOH(1’)。4Ce(OH)3+O2+2H2O=4Ce(OH)4(2’)
⑴左(2’)。CH4(1’);从右到左(2’),CO32-(1’)
⑵Fe-2e-=Fe2+(2’)、6Fe2++Cr2O72-+11H2O=6Fe(OH)3↓+2Cr3++4H+(2’)
⑶CO2(1’)
⑷CsOH(1’)。4Ce(OH)3+O2+2H2O=4Ce(OH)4(2’)
试题分析:(1)有外加电源时为电解池,左装置有外加电源属于电解池;没外加电源为原电池,右装置没有外加电源为CH4燃料电池;甲烷燃料电池中,通甲烷的一端为负极,负极发生氧化反应,甲烷失去电子,在碱性条件下生成碳酸根离子,负极反应为:CH4+10OH--8e-=CO32-+7H2O,电源中两电极间,带负电荷的CO32-离子向原电池的负极移动,所以运动的方向为从右到左.
(2)阳极活性电极铁,铁失去电子,电极方程式为:Fe-2e-=Fe2+;二价铁离子有还原性,Cr2O72-有强氧化性,二者能发生氧化还原反应,二价铁离子被氧化成三价铁离子,Cr2O72-被还原为Cr3+,反应方程式为:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O。
(3)制备中利用的原料,在转化过程中又生成的可以循环利用;由转化关系图知,通入氧气的一极为原电池的正极,其电极反应式为O2+4e-+2CO2=2CO32-,同时负极发生氧化反应,甲烷失去电子,在碱性条件下生成碳酸根离子,负极反应为:CH4+10OH--8e-=CO32-+7H2O,即A为CO2,同时可以判定CO2可以循环利用。
(4)同周期元素从左到右元素的金属性逐渐减弱,CS是元素周期表第六周期第ⅠA族元素,所以元素的金属性最强的是CS,氢氧化物中碱性最强的为CsOH,Ce(OH)3和Ce(OH)4中Ce的化合价分别为+3和+4,Ce(OH)3易被氧气氧化成Ce(OH)4,反应为:4Ce(OH)3+O2+2H2O=4Ce(OH)4,空气中含有水蒸气和氧气,所以Ce(OH)3对空气比较敏感。

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
 4LiCl +S+SO2。
4LiCl +S+SO2。



