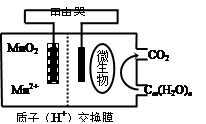
题目内容
分析下图所示的四个原电池装置,其中结论正确的是 ( )


| A.①②中Mg作负极,③④中Fe作负极 |
| B.②中Mg作正极,电极反应式为6H2O+6e-=6OH-+3H2↑ |
| C.③中Fe作负极,电极反应式为Fe-2e-=Fe2+ |
| D.④中Cu作正极,电极反应式为2H++2e-=H2↑ |
B
试题分析:A、②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,③中金属铁在常温下遇浓硝酸钝化,铜是负极失去电子,故A错误;B、②中的氧化还原反应发生在金属铝和氢氧化钠之间,失电子的是金属铝,为负极,Mg作为正极,电极反应式为6H2O+6e-═6OH-+3H2↑,故B正确;C、金属铁在常温下遇浓硝酸钝化,铜是负极失去电子,故C错误;D、铁、铜、氯化钠构成的原电池中,金属铁为负极,金属铜为正极,铁发生的是吸氧腐蚀,正极上是氧气得电子的过程,故D错误,故选B。

练习册系列答案
相关题目


 则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。
则反应2SO2(g)+O2(g) 2SO3(g)的△H= kJ·mol-l。使用V2O5作催化剂后该反应逆反应的活化能 (填“增大”、“不变”或“减小”)。


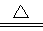 LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。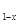 FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe—
FePO4之间的转化,电池放电时负极发生的反应为LiXC6-Xe—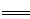 XLi++6C,写出电池放电时的电极反应的化学方程式 。
XLi++6C,写出电池放电时的电极反应的化学方程式 。