题目内容
【题目】常温下,用0.1mol/LNaOH溶液滴定10 mL 0.1 mol/LH2A溶液,溶液的pH与NaOH溶液的体积关系如图所示。下列说法不正确的是
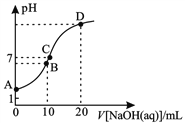
A. A点溶液中加入少量水:![]() 增大
增大
B. B点:c( HA -)>c(H+)>c(A2一)>c(H2A)
C. 水电离出来的c(OH -):B点>D点
D. C点:c(Na+) =c(HA-)+2c( A2-)
【答案】C
【解析】A. 根据图象可知,0.1mol/L的H2A溶液的pH大于1,说明H2A为弱酸,若A点溶液中加入少量水,溶液中氢离子、H2A的浓度减小,由于水的离子积不变,则氢氧根离子浓度增大,所以c(OH)/c(H2A)的比值增大,故A正确;B.B点时加入了10mLNaOH溶液,反应后溶质为NaHA,此时溶液的pH小于7,说明HA的电离程度大于其水解程度,则c(A2)>c(H2A),由于氢离子还来自水的电离,则c(H+)>c(A2),溶液中离子浓度大小为:c(HA)>c(H+)>c(A2)>c(H2A),故B正确;C.B点反应后溶质为NaHA,HA的电离程度大于其水解程度,溶液呈酸性,氢离子抑制了水的电离,而D点加入20mL氢氧化钠溶液,二者恰好反应生成Na2A,A2水解促进了水的电离,所以水电离的c(OH):B点<D点,故C错误;D.C点溶液的pH=7,为中性溶液,则c(H+)=c(OH),根据电荷守恒c(Na+)+c(H+)=c(HA)+2c(A2)+c(OH)可知:c(Na+)=c(HA)+2c(A2),故D正确;故选C。

【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(1)已知上述反应中相关的化学键键能数据如下:
化学键 | C-H | C=O | H-H | C≡O(CO) |
键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
则该反应的△H=______kJ·mol-1。
(2)为了加快该反应的速率,可以进行的措施是(_____)。
A.恒温恒压下,按原比例充入CH4、CO2
B.恒温下,缩小容器体积
C.增大反应物与催化剂的接触面积
D.降低温度
(3)恒温下,向2L体积恒定的容器中充入一定量的CO2、CH4,使其在催化剂作用下进行反应,经tmin后,测得CO有amol,则v(CO2)=______。下列各项能说明该反应达到平衡的是(______)。
A.容器内气体密度保持一定 B.容器内CO2、CH4的浓度之比为1∶1
C.该反应的正反应速率保持一定 D.容器内气体压强保持一定
(4)用甲烷作燃料的碱性燃料电池中,电极材料为多孔惰性金属电极,则负极的电极反应式为_______________。
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐及SiO2杂质)为原料生产金属锰的工艺流程如下:

已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是____________________(至少答两条)
(2)步骤Ⅱ中,加氨水调节溶液的pH为5.0~6.0,则滤渣1的成分主要为______(填化学式);已知MnO2的作用为氧化剂,“除杂1”中涉及的离子方程式为:NH3﹒H2O+H+==NH4+ +H2O、__________________、___________________。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是_______________________。
(4)滤液2中,c(Co2+) :c(Ni2+)=_______________。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,假设滤渣1为含铁元素的纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为_________(用含a、b、c的式子表达,无需化简)。