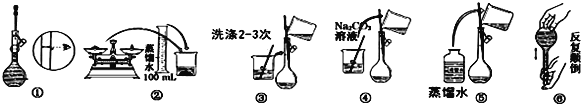
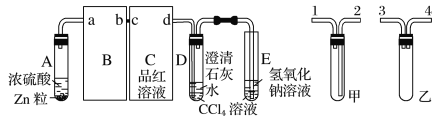
��Ŀ����
����Ŀ�������£���Ũ�Ⱦ�Ϊ0.1 mol��L-l������4����Һ��
��NaCN��Һ ��NaOH��Һ ��CH3COONa��Һ ��NaHCO3��Һ

(1)��4����ҺpH�ɴ�С��˳����____������ţ������Т���ˮ�����H+Ũ��Ϊ____��
(2)���и�����Ũ���ɴ�С��˳���� ___��
(3)�ܵ�ˮ��ƽ�ⳣ��Kh=___mol/L��
(4)���������Ģۺ͢��еμ������������ԣ�����������������___ �ܣ��>������<"����=����
(5)25��ʱ�����HCN��NaCN�Ļ����Һ��pH=11����![]() ԼΪ____����NaCN��Һ��ͨ������CO2��������Ӧ�����ӷ���ʽΪ��____��
ԼΪ____����NaCN��Һ��ͨ������CO2��������Ӧ�����ӷ���ʽΪ��____��
���𰸡� �������������� 1.0��10-13mol/L c��Na+����c��CN-����c��OH-����c��H+�� 2.5��10-8 �� 0.02 CN-+CO2+H2O=HCN+HCO3-
��������(1)��ͬŨ�ȵ���Һ�У���NaCN��Һˮ���Լ�������NaOH��ҺΪǿ����Һ����CH3COONa��Һ�Լ��ԣ���NaHCO3��Һˮ���Լ��ԣ���Ϊ���ԣ����̼�HCN��̼��������ӣ�Խ��Խˮ�⣬�����Һ�ļ��Ԣ���������������4����ҺpH�ɴ�С��˳���Ǣ���������������0.1 mol��L-l��NaOH��pH=13����ˮ�����H+Ũ��Ϊ1.0��10-13 mol/L���ʴ�Ϊ������������������1.0��10-13 mol/L��
(2)NaCN��Һ�У�CN-ˮ�⣬��Һ��ʾ���ԣ�NaCN��Һ������Ũ�ȴ�С��ϵΪ��c(Na+)��c(CN-)��c(OH-)��c(H+)���ʴ�Ϊ��c(Na+)��c(CN-)��c(OH-)��c(H+)��
(3)��HCO3-��ˮ�ⳣ��ΪK��K=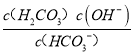 =
=![]() =
=![]() =2.5��10-8���ʴ�Ϊ��2.5��10-8��
=2.5��10-8���ʴ�Ϊ��2.5��10-8��
(4) �����Ũ�Ⱦ�Ϊ0.1 mol��L-l�Ģ�CH3COONa��Һ�͢�NaHCO3��Һ��̼������ˮ��̶ȴ��ڴ����ƣ���Һ�ļ���ǿ�ڴ����ƣ��μ������������ԣ��������������������ܣ��ʴ�Ϊ������
(5)��HCN�ĵ���ƽ�ⳣ��Ka=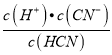 ����֪
����֪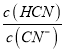 =
=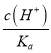 =
=![]() mol/L��0.02mol/L��̼���һ�����볣������HCN�ģ��������볣��С��HCN�ģ���̼�������ǿ��HCN��Ϊ̼���������������HCN������NaCN��Һ��ͨ������CO2����Ӧ����HCN��NaHCO3���÷�Ӧ���ӷ���ʽΪ��CN-+CO2+H2O=HCN+HCO3-���ʴ�Ϊ��0.02��CN-+CO2+H2O=HCN+HCO3-��
mol/L��0.02mol/L��̼���һ�����볣������HCN�ģ��������볣��С��HCN�ģ���̼�������ǿ��HCN��Ϊ̼���������������HCN������NaCN��Һ��ͨ������CO2����Ӧ����HCN��NaHCO3���÷�Ӧ���ӷ���ʽΪ��CN-+CO2+H2O=HCN+HCO3-���ʴ�Ϊ��0.02��CN-+CO2+H2O=HCN+HCO3-��

����Ŀ����3�������Ϊ1 L�ĺ����ܱ������з�����Ӧ��SO2(g)��2NO(g)![]() 2NO2(g)��S(s)���ı�����I�ķ�Ӧ�¶ȣ�ƽ��ʱc( NO2)���¶ȵĹ�ϵ����ͼ��ʾ������˵����ȷ����
2NO2(g)��S(s)���ı�����I�ķ�Ӧ�¶ȣ�ƽ��ʱc( NO2)���¶ȵĹ�ϵ����ͼ��ʾ������˵����ȷ����

���� ��� | �¶�/K | ��ʼ���ʵ���/mol | |||
SO2 | NO | NO2 | S | ||
�� | 0.5 | 0.6 | 0 | 0 | |
�� | T1 | 0.5 | 1 | 0.5 | 1 |
�� | T2 | 0.5 | 0.2 | 1 | 1 |
A. �÷�Ӧ�Ħ�H<0
B. T1ʱ���÷�Ӧ��ƽ�ⳣ��Ϊ![]()
C. �����������������T1ʱ�ﵽƽ�⣬��ѹǿ֮��С��1:2
D. ��T2<T1���ﵽƽ��ʱ����������NO���������С��40%