题目内容
【题目】已知:
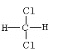
①H2(g)+![]() O2(g)
O2(g) ![]() H2O(g);ΔH1= a kJ·mol-1
H2O(g);ΔH1= a kJ·mol-1
②2H2(g)+O2(g) ![]() 2H2O(g);ΔH2= b kJ·mol-1
2H2O(g);ΔH2= b kJ·mol-1
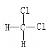
③H2(g)+![]() O2(g)
O2(g)![]() H2O(l);ΔH3= c kJ·mol-1
H2O(l);ΔH3= c kJ·mol-1
④2H2(g)+O2(g)![]() 2H2O(l);ΔH4= d kJ·mol-1
2H2O(l);ΔH4= d kJ·mol-1
下列关系正确的是( )
A. c<a <0 B. b>a > 0 C. 2a=d <0 D. 2c=d >0
【答案】A
【解析】
比较焓变的大小,注意正负号,放热反应:△H<0,吸热反应:△H>0。
氢气与氧气反应是放热反应,△H<0,即a、b、c、d都小于0,A、水蒸气转化成液态水,是放热过程,即c<a<0,故A正确;B、根据热化学反应方程式,2a=b,因此有b<a<0,故B错误;C、根据以上分析,得出d<2a<0,故C错误;D、2c=d<0,故D错误。

 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案【题目】欲测定某NaOH溶液的物质的量浓度,可用0.1000mol·L-1HCl标准溶液进行中和滴定(用甲基橙作指示剂)。
请回答下列问题:
(1)滴定时,盛装待测NaOH溶液的仪器名称为 ,盛装标准盐酸的仪器名称为 ;滴定至终点的颜色变化为 。
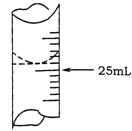
(2)若甲学生在实验过程中,记录滴定前滴定管内液面读数为0.50mL,滴定后液面如图,则此时消耗标准溶液的体积为 。
(3)乙学生做了三组平行实验,数据记录如下:
实验序号 | 待测NaOH溶液的体积/mL | 0.1000mol·L-1HCl溶液的体积/mL | |
滴定前刻度 | 滴定后刻度 | ||
1 | 25.00 | 0.00 | 26.29 |
2 | 25.00 | 1.56 | 31.30 |
3 | 25.00 | 1.00 | 27.31 |
选取上述合理数据,计算出待测NaOH溶液的物质的量浓度为 (保留四位有效数字)。
(4)下列哪些操作会使测定结果偏高 (填序号)。
A.锥形瓶用蒸馏水洗净后再用待测液润洗
B.酸式滴定管用蒸馏水洗净后再用标准液润洗
C.滴定前酸式滴定管尖端气泡未排除,滴定后气泡消失
D.滴定前读数正确,滴定后俯视滴定管读数
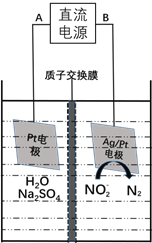
【题目】“绿水青山就是金山银山”,研究NO2、NO、CO、NO2- 等大气污染物和水污染物的处理对建设美丽中国具有重要意义。
(1)已知:①NO2 + CO ![]() CO2 + NO 该反应的平衡常数为K1(下同)
CO2 + NO 该反应的平衡常数为K1(下同)
每1mol下列物质分解为气态基态原子消耗能量分别为
NO2 | CO | CO2 | NO |
812kJ | 1076kJ | 1490kJ | 632kJ |
②N2(g)+O2(g) ![]() 2NO(g) ΔH=+179.5 kJ/mol K2
2NO(g) ΔH=+179.5 kJ/mol K2
③2NO(g) +O2(g)![]() 2NO2(g) ΔH=-112.3 kJ/mol K3
2NO2(g) ΔH=-112.3 kJ/mol K3
试写出NO与CO反应生成无污染物气体的热化学方程式____________________________以及此热化学方程式的平衡常数K=____________(用K1、K2、K3表示)
(2)污染性气体NO2与CO在一定条件下的反应为:2NO2+4CO![]() 4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的
4CO2+N2,某温度下,在1L密闭容器中充入0.1mol NO2和0.2mol CO,此时容器的压强为1个大气压,5秒时反应达到平衡时,容器的压强变为原来的![]() ,则反应开始到平衡时CO的平均反应速率v(CO)=________。
,则反应开始到平衡时CO的平均反应速率v(CO)=________。
若此温度下,某时刻测得NO2、CO、CO2、N2的浓度分别为amol/L、0.4mol/L、0.1mol/L、1mol/L,要使反应向逆反应方向进行,a的取值范围________________。
(3)电化学降解NO2-的原理如下图:
①电源的负极是____________(填A或B)阴极反应式为________________。
②若电解过程中转移了6mol电子,则膜两侧电解液的质量变化差![]() 为_____g。
为_____g。