题目内容
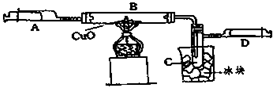
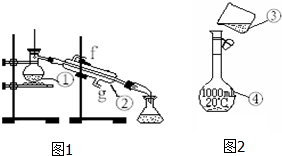
3.某同学设计了如图所示的实验装置,来粗略地测定电石中碳化钙的质量分数.(1)烧瓶中发生反应的化学方程式为CaC2+2H2O→Ca(OH)2+C2H2↑;装置B、C的作用分别是B贮水,以使烧瓶A中产生的CH≡CH进入B时,排出与它等体积的水进入量筒,C测定乙炔的体积.(2)为了除去杂质气体,可以使用硫酸铜溶液,其离子反应方程式为Cu2++H2S=CuS↓+2H+;
(3)实验中测得排入量筒中水的体积为VL、电石的质量为Wg.则电石中碳化钙的质量分数是$\frac{2.86V}{W}$%(不计算导管中残留的水,气体中饱和的水蒸气等也忽略不计).

分析 (1)电石和水反应的方程式为CaC2+2H2O→Ca(OH)2+C2H2↑;装置BC是排水量气方法测定生成乙炔的体积;
(2)电石和水反应生成的乙炔中含有杂质硫化氢气体,通过硫酸铜溶液除去;
(3)依据反应定量关系CaC2-----C2H2,计算得到乙炔的质量,计算电石中CaC2的质量分数;
解答 解:(1)电石和水反应的方程式为CaC2+2H2O→Ca(OH)2+C2H2↑;装置B用于贮水以便烧瓶中生成的C2H2气体进入B时排出与它等体积的水进入量筒C来测定生成乙炔的量;
故答案为:CaC2+2H2O→Ca(OH)2+C2H2↑,装置B用于贮水以便烧瓶中生成的C2H2气体进入B时排出与它等体积的水进入量筒,C来测定生成乙炔的量;
(2)电石和水反应生成的乙炔中含有杂质硫化氢气体,通过硫酸铜溶液除去,反应的离子方程式为:Cu2++H2S=CuS↓+2H+,
故答案为:Cu2++H2S=CuS↓+2H+;
(3)设产生VmL气体需要CaC2的质量为mg,则
CaC2-----C2H2,
64g 22400mL
m VmL
解得m=0.00286V,则电石中CaC2的质量分数为$\frac{0.00286V}{W}$×100%=$\frac{2.86V}{W}%$;
故答案为:$\frac{2.86V}{W}%$;
点评 本题考查了物质性质的探究实验分析判断,实验数据的分析和计算,乙炔性质和制备,掌握实验基本操作和实验设计方法是解题关键,题目难度中等.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
12.结构简式为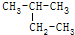 的烃,其正确的命名是( )
的烃,其正确的命名是( )
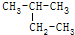 的烃,其正确的命名是( )
的烃,其正确的命名是( )| A. | 1,1-二甲基丙烷 | B. | 2-乙基丙烷 | C. | 3-甲基丁烷 | D. | 2-甲基丁烷 |
13.下列芳香烃中,属于苯的同系物是( )
| A. |  | B. |  | ||
| C. |  | D. |  |

 .
.