题目内容
13.前18号元素中,具有相同电子层结构的三种离子An+、Bn-、C,下列分析正确的是( )| A. | 原子序数关系是C>B>A | B. | 粒子半径关系是Bn-<An+ | ||
| C. | C一定是稀有气体元素的一种原子 | D. | 原子半径关系是A<B. |
分析 前18号元素中,具有相同电子层结构的三种粒子An+、Bn-、C,则核外电子数目相同,C为原子,所以C为稀有气体元素的一种原子,A处于B的下一周期,电子层结构相同的离子,其原子序数越大,离子半径越小,结合元素周期律知识进行判断.
解答 解:前18号元素中,具有相同电子层结构的三种粒子An+、Bn-、C,则核外电子数目相同,最外层均有8个电子,C为原子,所以C为稀有气体元素的一种原子,A处于B的下一周期;
A.B、C同周期,A处于B的下一周期,所以原子序数关系是A>C>B,故A错误;
B.电子层结构相同的离子,其原子序数越大,离子半径越小,A处于B的下一周期,所以粒子半径关系是Bn->An+,故B错误;
C.C为稀有气体元素的一种原子,故C正确;
D.A处于B的下一周期,所以原子半径关系是A>B,故D错误.
故选C.
点评 本题考查了半径比较、核外电子排布、结构与位置关系,难度不大,判断X、Y的位置关系是关键,要灵活运用元素周期律知识解答,侧重于考查学生的分析能力和应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
15.以NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 84gNaHCO3晶体中含有NA个CO32- | |
| B. | 1.8g重氧水中(H218O)含有NA个中子 | |
| C. | 标准状况下,11.2LO3中含有NA个氧原子 | |
| D. | 0.1molH3O+中含有NA个电子 |
1.在无色透明的强酸性溶液中,能大量共存的是( )
| A. | Na+、NO3-、Al3+、Cl- | B. | Na+、CO32-、Ca2+、NO3- | ||
| C. | K+、SO42-、Cl-、Cu2+ | D. | Ba2+、Cl-、K+、SO42- |
18. 如图是两个反应的反应前后反应物总能量和生成物总能量的比较图,对于Ⅰ、Ⅱ两个反应的说法正确的是( )
如图是两个反应的反应前后反应物总能量和生成物总能量的比较图,对于Ⅰ、Ⅱ两个反应的说法正确的是( )
 如图是两个反应的反应前后反应物总能量和生成物总能量的比较图,对于Ⅰ、Ⅱ两个反应的说法正确的是( )
如图是两个反应的反应前后反应物总能量和生成物总能量的比较图,对于Ⅰ、Ⅱ两个反应的说法正确的是( )| A. | 反应Ⅰ是放热反应,反应Ⅱ也是放热反应 | |
| B. | 反应Ⅰ是放热反应,反应Ⅱ是吸热反应 | |
| C. | 反应Ⅰ是吸热反应,反应Ⅱ也是吸热反应 | |
| D. | 反应Ⅰ不需要加热,反应Ⅱ必须加热 |
5.今有如下三个热化学方程式:
H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=aKJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=bkJ•mol-1
2H2(g)+O2(g)=2H2O(l);△H=ckJ•mol-1
关于它们的下列表述不正确的是( )
H2(g)+$\frac{1}{2}$O2(g)=H2O(g);△H=aKJ•mol-1
H2(g)+$\frac{1}{2}$O2(g)=H2O(l);△H=bkJ•mol-1
2H2(g)+O2(g)=2H2O(l);△H=ckJ•mol-1
关于它们的下列表述不正确的是( )
| A. | 它们都是放热反应 | B. | a 和b的绝对值可以相等 | ||
| C. | a、b和c均为负值 | D. | 2b=c |
3.下述实验方案能达到实验目的是( )
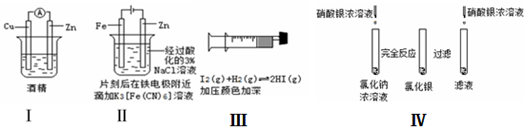

| A. | 方案Ⅰ验证金属活泼性:Zn>Cu | |
| B. | 方案Ⅱ验证Fe电极被保护 | |
| C. | 方案Ⅲ验证平衡移动原理 | |
| D. | 方案Ⅳ验证氯化银在水中存在溶解平衡 |
